
| A. | ①②③ | B. | ①③⑤ | C. | ①②⑤ | D. | ①②⑤⑥ |
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
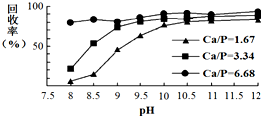 三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用.近年来,三氯氧磷的工业生产由三氯化磷的“氧气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到). AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)
AgSCN(S)+Cl-(aq);该反应使测定结果偏低;(填偏高,偏低或不变)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
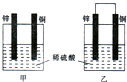 锌是一种较活泼的金属,具有广泛的用途.
锌是一种较活泼的金属,具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对废旧电池进行回收处理 | |
| B. | 购物时尽量不用塑料袋 | |
| C. | 对聚乙烯等塑料垃圾进行深埋或倾倒入海 | |
| D. | 使用沼气、太阳能、风能等能源替代传统的煤炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18mol/L的浓硫酸15mL L | B. | 0.2mol/L的盐酸12mL | ||
| C. | 0.15mol/L的硫酸溶液8mL | D. | 0.1mol/L的盐酸15m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com