

| 5-3 |
| 2 |
| 1 |
| 8 |
| ||
| ||
| 1 |
| 8 |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案科目:高中化学 来源: 题型:
| A、不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- |
| D、无色透明溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (l)+H2(g)→
(l)+H2(g)→ (l)△H>0 ①
(l)△H>0 ① (l)+2H2(g)→
(l)+2H2(g)→ (l)△H<0 ②
(l)△H<0 ②| A、反应①、②都属于加成反应 |
| B、l,3一环己二烯比苯稳定 |
| C、反应①、②的热效应说明苯环中含有的并不是碳碳双键 |
| D、反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
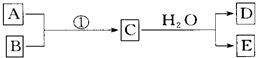
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题:
前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①② | B、①④ | C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com