
| A. | 苏打 | B. | 食盐 | C. | 干冰 | D. | 金刚石 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 →
→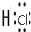 .
. 或
或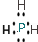 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
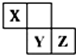 X、Y、Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( )
X、Y、Z三种短周期元素在周期表中的位置如图,其中Z单质可用于工业制漂白粉,下列说法不正确的是( )| A. | Y的非金属性比Z的弱 | |
| B. | 三种元素均为非金属元素 | |
| C. | Z形成的气态氢化物比Y形成的气态氢化物稳定 | |
| D. | Y元素的最高正化合价比Z元素的最高正化合价高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 220mL | B. | 240mL | C. | 260mL | D. | 280mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子与氯离子F之间存在互相吸引又互相排斥的相互作用 | |
| B. | 不存在氯化钠的分子 | |
| C. | 每个钠离子同时吸引6个氯离子,每个氯离子同时吸引6个钠离子 | |
| D. | 在一个钠离子周围距离相等,并且最接近的钠离子共有6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com