
| A. | 稳定性:NH3>PH3>SiH4 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br- |
分析 同周期元素的原子从左到右,最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱;同主族元素的原子从上到下,最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;同周期元素的原子从左到右,原子半径逐渐减小,得电子能力逐渐增强,氢化物的稳定性逐渐增强,失电子能力逐渐减弱,单质的还原性逐渐减弱.
解答 解:A.同周期元素的原子从左到右,原子半径逐渐减小,得电子能力逐渐增强,氢化物的稳定性逐渐增强,稳定性:PH3>SiH4,同主族元素,从上到下非金属性减弱,故稳定性NH3>PH3,故A正确;
B.同周期元素的原子从左到右,最高价氧化物对应水化物的酸性逐渐增强,同主族元素的原子从上到下,最高价氧化物对应水化物的酸性逐渐减弱,所以酸性:HClO4>H2SO4>H3PO4,故B正确;
C.同周期元素的原子从左到右,最高价氧化物对应水化物的碱性逐渐减弱,主族元素的原子从上到下,最高价氧化物对应水化物的碱性逐渐增强,所以碱性:碱性:KOH>NaOH>Mg(OH)2,故C正确;
D.非金属性F>Cl>Br,对应离子的还原性为F-<Cl-<Br-,故D错误,
故选D.
点评 本题考查金属性和非金属性,明确物质的酸性、气态氢化物的稳定性,碱性与非金属性、金属性的关系是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 金刚石和石墨 | ||
| C. | CH3CH=CH2和环丙烷 | D. | 丁烷和异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++OH-═NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
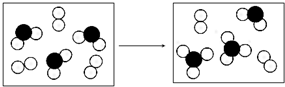
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 欲配制1.00 L 1.00mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0g金属钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com