
【题目】某溶液中只含有Na+、Cl-、Fe3+、SO42-等四种离子,已知前三种离子的个数比为3:1:2,则溶液中Fe3+与SO42-的个数比( )
A. 1:2 B. 1:4 C. 3:4 D. 1:1
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如以下左图所示。

根据判断出的元素回答问题:
(1)A、B均为以上某两种元素组成的分子,A中有四个原子核和10个电子,B中有6个原子核和18个电子,则A的分子式为________,B的分子式为_________。
(2)比较e、f离子的半径大小(用元素离子符号表示)__________________;非金属性g_____h(填“强于”或“弱于”),用一个化学方程式证明你的推论 ________。
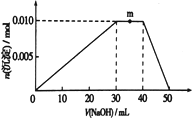
(3)上述元素可组成盐R【化学式为zx4f(gd4)2】,向盛有10mL1mol·L1R溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如以上右图:
①上述NaOH溶液物质的量的浓度为_________________________。
②写出m点反应的离子方程式______________________________。
③若向R溶液中改加20mL1.1mol·L1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业,电真空照明材料等方面。黑钨矿是一种有开采价值的钨矿石,其主要成分是铁和锰的钨酸盐(常用FeWO4、MnWO4表示)。它的传统冶炼工艺的第一阶段如下图所示:

注:①上述流程中钨的化合价不变 ②钨酸(H2WO4)是一种难溶性酸
(1)写出C的化学式:______;写出生成B的化学方程式:_________
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有_________,请写出FeWO4在熔融条件下发生反应生成该成分的化学方程式_________
(3)冶炼金属钨是用非整比的钨氧化物为原料,钨元素在其中存在两种价态:+5价和+6价,试确定组成为WO2.7的氧化钨中两种对应价态的钨原子个数的整数比为_____________。
(4)黑钨矿还含少量Si、As的化合物,上述流程需优化(见下图)。向含Na2WO4的滤液中加硫酸调节pH=10后,再除杂净化。

则“净化”过程中,加入H2O2的目的是__________,滤渣Ⅰ的主要成分是____________。
(5)某温度下,Ca(OH)2、CaWO4的相关数据见下表
项目 | CaWO4 | Ca(OH)2 |
-lgc(阴离子) | 4 | 2 |
-lgc(Ca2+) | 6 | 4 |
将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
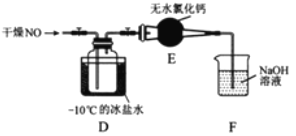
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明酸性溶液中,下列各组离子能大量共存的是( )
A.Na+、K+、OH-、Cl-
B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-
D.K+、Na+、NO3-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼( N2H4)和偏二甲肼(C2H8N2 )常用于火箭推进剂和燃料电池,NO2的二聚体N2O4 则是火箭中常用氧化剂。回答下列问题:
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_____________________;电池工作时OH-向____________移动(填“负极”或“正极”),整个溶液的碱性_________(填“减小”或“增大”)。

(2)火箭常用 N2O4 作氧化剂,肼作燃料,已知:
①N2(g)+2O2(g)=2NO2(g) △H1=-66.7kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-530.5kJ·mol-1
③2NO2(g) ![]() N2O4(g) △H3=-55.7kJ·mol-1
N2O4(g) △H3=-55.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:______________。
(3)“长征二号”火箭所用的燃料是偏二甲肼(C2H8N2)(其中N的化合价为-3)和四氧化二氮(N2O4)。在火箭升空过程中燃料发生反应 C2H8N2 +2N2O4=2CO2↑+3N2↑+4H2O↑。下列有关叙述正确的是_____________________
A. 该反应中N2O4是氧化剂,偏二甲肼是还原剂 B. 每消耗1molC2H8N2,转移电子数目为16NA
C. CO2既不是氧化产物也不是还原产物 D. N2既是氧化产物又是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com