
 减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要.汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全.
减少交通事故除遵守交通法规正确驾驶外,安全措施也极为重要.汽车的安全气嚢内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质.当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生分解反应,产生大量气体,充满气囊,从而保护驾驶员和乘客的安全.分析 (1)A.道路起雾,水分子不变;
B.NH4NO3含离子键、共价键;
C.NaN3受到猛烈撞击时,发生化学变化;
D.含离子键的一定为离子化合物;
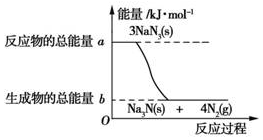
(2)①由图可知,反应物的总能量大于生成物的总能量;
②发生3NaN3═Na3N+4N2↑,氮气中N≡N非极性键,由反应及图可知生成12mol非极性键放热为(a-b)kJ;
③n(NaN3)=$\frac{292.5g}{65g/mol}$=4.5mol,由反应可知生成n(N2)=4.5mol×$\frac{4}{3}$=6mol,结合v=$\frac{△c}{△t}$计算.
解答 解:(1)A.道路起雾,水分子不变,水分子中化学键不变,故A错误;
B.NH4NO3含离子键、共价键,N、O之间为极性共价键,故B错误;
C.NaN3受到猛烈撞击时,发生化学变化,化学键断裂和生成,故C正确;
D.含离子键的一定为离子化合物,则NaN3、NH4NO3均属于离子化合物,故D正确;
故答案为:CD;
(2)①由图可知,反应物的总能量大于生成物的总能量,为放热反应,故答案为:放热;
②发生3NaN3═Na3N+4N2↑,氮气中N≡N非极性键,由反应及图可知生成12mol非极性键放热为(a-b)kJ,则有18mol 非极性键生成(一个共用电子对为一个化学健),则反应的能量变化为(a-b)kJ×$\frac{18}{12}$=1.5(a-b)kJ,消耗叠氮化钠的质量为$\frac{1.5(a-b)×3}{(a-b)}$mol×65g/mol=292.5g,
故答案为:1.5(a-b);292.5;
③n(NaN3)=$\frac{292.5g}{65g/mol}$=4.5mol,由反应可知生成n(N2)=4.5mol×$\frac{4}{3}$=6mol,则用N2表示的反应速率为$\frac{\frac{6mol}{VL}}{ts}$=$\frac{6}{Vt}$mol/(L•s),
故答案为:$\frac{6}{Vt}$mol/(L•s).
点评 本题考查反应热与焓变及化学键,为高频考点,把握图中能量变化、反应中能量变化、化学键的判断为解答的关键,侧重分析与应用能力的考查,注意氮气中化学键的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(OH-)═c(H+)+c( HA-) | B. | c(Na+)═2c(A2-)+2c(HA-) | ||
| C. | c(A2-)+c(HA-)+c(H2A)═0.1mol•L-1 | D. | c(Na+)+c(H+)═c(OH-)+c(HA-)+2c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
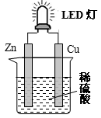
| A. | 铜是负极,电子从铜片经导线流向锌片 | |
| B. | 大多数氢离子在锌片上获得电子被还原 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将硫酸换成西红柿汁,导线中不会有电子流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它与足量的水反应的化学方程式为:NH5+H2O═NH3•H2O+H2↑ | |
| B. | NH5中只有极性共价键的共价化合物 | |
| C. | 1molNH5中含有5NA个N-H键(NA表示阿伏伽德罗常数) | |
| D. | NH5中所有原子最外层均为8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述热化学方程式说明反应物的总键能大于生成物的总键能 | |
| B. | 达平衡后再通入NH3,则平衡正向移动,NH3转化率减小 | |
| C. | 达平衡后升温,则逆反应速率加快,正反应速率减慢,平衡逆向移动 | |
| D. | 达平衡后加入催化剂能同时增大正逆反应速率,平衡发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl是氧化产物 | |
| B. | 每生产1mol Na2Mn5O10转移3mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 正极反应式:Ag+Cl--e-═AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 同主族元素的最外层电子数相同 | 同主族元素的化学性质一定相似 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | S的非金属性比Si强 | 酸性:H2SO4>H4SiO4 |
| D | Na在Cl2中燃烧的生成物含离子键 | NaCl固体可导电 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com