
 展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学
展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学 手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
 (填序号)。
(填序号)。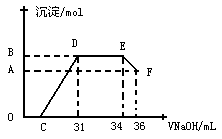
 对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL科目:高中化学 来源:不详 题型:实验题

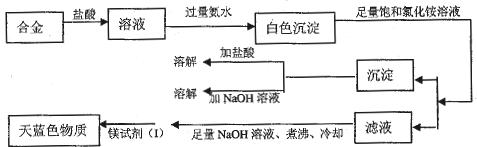
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 试管B中的现象是___________________,
试管B中的现象是___________________,查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
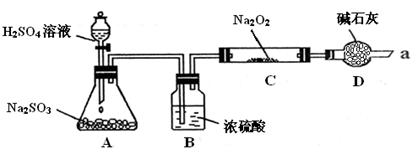

| 实验步骤 | 实验现象 |
| ①滴加入过量的稀盐酸 | 产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 | 产生白色沉淀。 |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
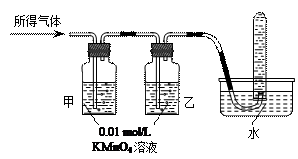 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL 稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1 mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。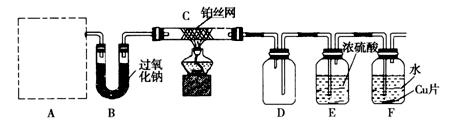
 __。
__。 ____________________________________________________________。
____________________________________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.将乙醇蒸汽通过 灼热的氧 灼热的氧 化铜,固体颜色由黑色变为红色 化铜,固体颜色由黑色变为红色 |
| B.苯在一定温度、压强和催化剂的作用下和氢气反应,生成环己烷 |
| C.一定条件下,将苯滴入浓硝酸和浓硫酸的混合液中,有油状物生成 |
| D.往溴水中加入四氯化碳溶液,水层褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com