
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A、离子半径大小:R3+<X+<M2- |
| B、Y与M组成的化合物是光化学烟雾的原因之一 |
| C、将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生 |
| D、M氢化物的熔沸点高于Z氢化物的熔沸点 |


科目:高中化学 来源: 题型:
| A、1:4 | B、4:1 |
| C、1:9 | D、9:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、纯净物(B)与混合物(A)属于包含关系 |
| B、化合物(B)与氧化物(A)属于包含关系 |
| C、单质与化合物属于交叉关系 |
| D、氧化反应与化合反应属于并列关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol任何纯净物都含有相同的原子数 |
| B、1molO2中约含有6.02×1023个氧分子 |
| C、1mol水中含有8mol电子 |
| D、阿伏加德罗常数就是6.02×1023mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学不做实验,就什么都不知道 |
| B、化学不再需要实验 |
| C、化学不再是纯实验科学 |
| D、未化学的方向是经验化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、②③ | C、③④ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
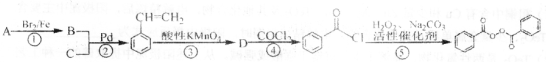
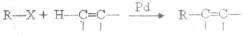
 ),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;
),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com