
【题目】短周期元素X、Y、Z、W原子序数依次增大,它们原子的最外层电子数之和为14。X与Z同主族,Y与W同主族,且X的原子半径小于Y。下列叙述正确的是( )
A.原子半径:Y<Z<W
B.Z在化合物中呈+1价
C.Y与W可形成离子化合物
D.W的单质能在Y的单质中燃烧生成WY3
【答案】B
【解析】
短周期元素X、Y、Z、W的原子序数依次增大,X与Z同主族,Y与W同主族,则Y与W分别位于第二、第三周期,X的原子半径小于Y,X不可能处于第二周期,故X为H元素,Z为Na元素,X、Y、Z、W的原子最外层电子数之和为14,故Y、W的最外层电子数为![]() =6,故Y为O元素,W为S元素。
=6,故Y为O元素,W为S元素。
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>S>O,即Z>W>Y,故A错误;
B.Z为Na元素,原子最外层电子数为1,在化合物中呈+1价,故B正确;
C.Y为O元素,W为S元素,二者形成的化合物SO2、SO3,都属于共价化合物,故C错误;
D.Y为O元素,W为S元素,S在氧气中燃烧生成SO2,故D错误;
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:


实验步骤: 在A中加入4.4 g异戊醇(![]() ),6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
),6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)仪器B的名称是_________________。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是________ (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)在洗涤操作中,第一次水洗的主要目的是________,第二次水洗的主要目的是___________。
(4)分液漏斗在使用前须清洗干净并_______,在洗涤、分液操作中,应充分振荡,然后静置,待分层后_________________(填标号),
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(5)本实验中加入过量乙酸的目的是_________________。
(6)实验中加入少量无水MgSO4的目的是_____________。
(7)在蒸馏操作中,仪器选择及安装都正确的是_____________ (填标号) 。

(8)本实验的产率是_____________
a. 30% b. 40% c. 50% d. 60%
(9)在进行蒸馏操作时,若从130 ℃开始收集馏分,会使实验的产率偏_____________ (填“高”或“低”),其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:

A为一元羧酸,8.8g A与足量NaHCO3溶液反应生成2.24L CO2(标准状况),A的分子式为( )
A. C2H4O2B. C3H6O2C. C4H8O2D. C5H10O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表达正确的是( )
A. 原子核内有10个中子的氧原子:![]() O
O
B. 氯原子的结构示意图:![]()
C. Fe3+的最外层电子排布式:3s23p63d5
D. 基态铜原子的外围电子轨道表示式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买同的硫酸试剂标签上的部分内容。据此下列说法正确的是
硫酸化学纯(CP)
(500mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84g / cm3
质量分数:98%
A.该硫酸的物质的量浓度为1.84mol/L
B.1mol Zn与足量的该硫酸反应产生2gH2
C.配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D.该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是( )
A. ClO3-的空间构型为平面三角形
B. SiF4和SO32-的中心原子均为sp2杂化
C. C2H2分子中σ键与π键的数目比为1︰1
D. SF6中有6对相同的成键电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用6 g CaCO3与100 mL稀盐酸反应制取少量的CO2,反应过程中生成的CO2的体积(已折算为标准状况)随反应时间变化的情况如右图所示。下列说法正确的是

A. OE段表示的平均反应速率最快,可能的原因是该反应是放热反应
B. EF段用HC1浓度的减小表示的该反应的平均反应速率为0.2 mol/(L·min)
C. 在F点收集到的CO2的体积最大
D. 在G点以后收集的CO2的量不再增多,原因是稀盐酸已反应完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、 丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是
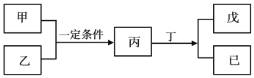
A.原子半径:Z>Y>X>W
B.W和X形成的化合物既可能含有极性键也可能含有非极性键
C.Z的氧化物对应的水化物均为强酸
D.简单氢化物的热稳定性:X<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠晶体为体心立方晶胞,实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com