
下列递变规律不正确的是 ( )
A.钠、镁、铝单质还原性依次减弱 B.碘、溴、氯单质氧化性依次增强 C.C、N、O原子半径依次减小 D.N、O、F最高正价依次升高
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水成分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_______________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
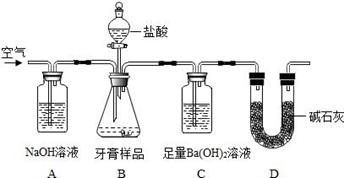
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:_________________________________。
(3)下列各项措施中,不能提高测定准确度的是_____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A—B之间增添盛有浓硫酸的洗气装置
d.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为_________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_________________________。
(6)将等体积的AlCl3与NaOH溶液混合,充分反应后,测得混合溶液中含有铝元素质量与是沉淀中含有铝元素质量的2倍,则c(AlCl3)与c(NaOH)的比值是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中要测定部分变质的过氧化钠的纯度,可用如图装置实现。
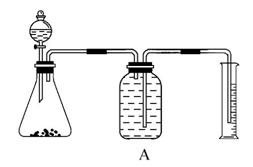
(1)锥形瓶中应放药品________,分液漏斗中放__________,锥形瓶中发生的化学方程式为_________________________________________。
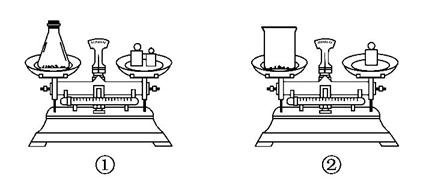
(2)如图用托盘天平称取样品,应选用如图中的__________(填“①”或“②”)。不选用另一装置的原因是___________________________________。
(3)若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),则样品中Na2O2的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应中,水可以作氧化剂,作还原剂,既作氧化剂又作还原剂,既不作氧化剂又不作还原剂。下列反应与Br2+SO2+2H2O====H2SO4+2HBr相比较,水的作用不相同的是( )
A.Cl2+H2O HCl+HClO B.2F2+2H2O====4HF+O2
HCl+HClO B.2F2+2H2O====4HF+O2
C.2Na2O2+2H2O====4NaOH+O2↑ D.4Fe(OH)2+O2+2H2O====4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的的是 ( )
A.用互相滴加的方法可鉴别氯化铝溶液、氢氧化钠溶液
B.向氯化铝溶液中滴加过量氨水,最终得到澄清溶液
C.常温下铝与浓硝酸反应制得大量的NO2
D.AlCl3溶液加热蒸干得到无水氯化铝晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是 ( )
A.铁粉和氯化铁溶液反应 Fe + 2Fe3+ → 3Fe2+
B.铁和稀盐酸反应 2Fe + 6H+ → 2Fe3+ + H2↑
C.硫化亚铁溶于稀硝酸中:FeS + 2H+ → Fe2++ H2S↑
D.铝和氢氧化钠溶液反应 2Al + 2OH- → 2AlO2- + 3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空。

(1)N在元素周期表中的位置是_____;N和F处于同一行,是由于它们的_________相同。
(2)以上元素中,原子半径最小的是_____(写元素符号);最高价氧化物对应水化物中酸性最强的是__________(写化学式)。
(3)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实____________________。
(4)S和Cl中,非金属性较强的是_____(写元素符号),不能说明该结论的事实是_____。
a.氯气与铁反应生成FeCl3,硫与铁反应生成FeS
b.把Cl2通入H2S溶液中能发生置换反应
c.受热时H2S易分解,HCl不易分解
d.单质硫是固体,氯的单质是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
甲和乙两烧杯中各装有100mL 0.2mol·L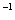 AlCl3溶液,向两烧杯中分别加入相同体积、相同浓度的NaOH溶液和氨水,两烧杯中都有沉淀生成。下列判断正确的是
AlCl3溶液,向两烧杯中分别加入相同体积、相同浓度的NaOH溶液和氨水,两烧杯中都有沉淀生成。下列判断正确的是
A.实验过程中甲中和乙中的现象始终保持一致 B.甲中沉淀一定比乙中的少
C.甲中沉淀可能比乙中的多 D.乙中沉淀可能比甲中的多
查看答案和解析>>
科目:高中化学 来源: 题型:
向某溶液中加入含有Fe2+的溶液后,无明显变化。当再滴入几滴新制氯水后,混合溶液变成红色,则下列结论错误的是( )
A.该溶液中一定含有SCN- B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氧化为Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com