
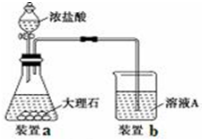
分析 (1)乙醇、浓硫酸和溴化钠加热反应生成溴乙烷、硫酸氢钠和水;
(2)浓硫酸具有强氧化性,温度过高会把溴离子氧化成红棕色的溴,同时浓硫酸被还原成二氧化硫;
(3)为了更好的控制温度,最好用水浴加热的方法;
(4)U型管得到了溴乙烷;溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑,分液用到分液漏斗;溴乙烷不溶于水,水洗后分液分离,再加入无水CaCl2,最后进行蒸馏操作;
(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成;有溴乙烷参加的主要反应是溴乙烷和碱溶液中的水解.
解答 解:(1)溴化钠、浓硫酸和乙醇制取溴乙烷的化学方程式为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O,
故答案为:NaBr+H2SO4+C2H5OH$\stackrel{△}{→}$NaHSO4+C2H5Br+H2O;
(2)由于浓硫酸具有强氧化性,会有溴生成,化学式为Br2,故答案为:Br2;
(3)为了更好的控制温度,除用图示的小火加热外,最好用水浴加热的方法,
故答案为:水浴加热;
(4)①在U型管内有制取的溴乙烷,所以现象是U型管底部有油状液体沉积,粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,
A.溴乙烷能够与氢氧化钠反应,故A错误;
B.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故B正确;
C.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故C错误;
加入氢氧化钠溶液洗涤后静置,萃取分液使用的主要仪器是分液漏斗,
故答案为:B;分液漏斗;
②要进一步制得纯净的C2H5Br,可用水洗,分液后再加入无水CaCl2,利用沸点不同再进行蒸馏分离,
故答案为:分液;蒸馏;
(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤③②,
故答案为:④①⑤③②.
点评 本题主要考查了溴乙烷的制备,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量数为78 | B. | 质子数为53 | C. | 核外电子数为131 | D. | 中子数为53 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
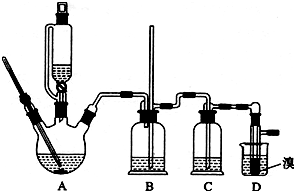
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/°C | 78.5 | 132 | 34.6 |
| 熔点/°C | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
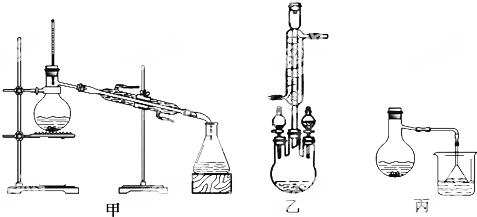
 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.61 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水中c(H+)=c(OH-) | B. | 纯水PH=7 | ||
| C. | 纯水的离子积KW=1.0×10-14 | D. | 纯水是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com