
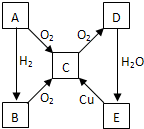
 A��B��C��D��E�����ʵ�ת����ϵ��ͼ��ʾ��
A��B��C��D��E�����ʵ�ת����ϵ��ͼ��ʾ��| O2 |
| O2 |
| H2O |
| O2 |
| O2 |
| H2O |
| O2 |
| O2 |
| H2O |
 ��
�� ��
��
| ||
| ���¸�ѹ |
| ||
| ���¸�ѹ |
| ||
| ||
| O2 |
| O2 |
| H2O |
| ||
| ||


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
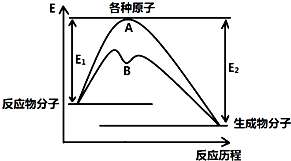 ��֪ij��Ӧ�ڲ�ͬ�����µķ�Ӧ���̿��Ա�ʾ����ͼ��ʾ��E1��ʾ��Ӧ����ӱ��ԭ�������յ�������E2��ʾ��Щԭ�����³ɼ��γ�������ų�����������ش��������⣺
��֪ij��Ӧ�ڲ�ͬ�����µķ�Ӧ���̿��Ա�ʾ����ͼ��ʾ��E1��ʾ��Ӧ����ӱ��ԭ�������յ�������E2��ʾ��Щԭ�����³ɼ��γ�������ų�����������ش��������⣺| ��ѧ�� | H-H | Cl-Cl | O=O | O-H | H-Cl |
| ���ܣ�kJ?mol-1�� | 436 | 247 | x | 463 | 431 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� |
| ������Һ |
| H+ |
| CH3OH/H+ |
| �� |
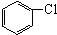 ��
��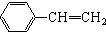 Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ�����л�����Ľṹ��ʽΪ
Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ�����л�����Ľṹ��ʽΪ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
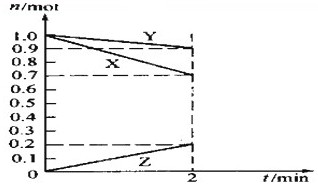 ��1����ӦA+3B=2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ
��1����ӦA+3B=2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش��������⣺
��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
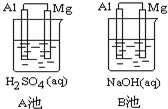 Al-Mg�ڲ�ͬ�ĵ������Һ�зֱ�ԭ���A��B����ͼ��ʾ��
Al-Mg�ڲ�ͬ�ĵ������Һ�зֱ�ԭ���A��B����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| T/�� | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com