
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式____,将54.8g Na2CO3和NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=____,气体V=____。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为____,若有2mol氯气参与该反应,则此时转移的电子数为____NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为____。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为____。
(5)葡萄糖(分子式C6H12O6)是人体活细胞的能量来源。已知1mol等于1000mmol,某体检单的一些指标如图,则每升该样品中含葡萄糖的质量为____g(请保留两位小数)。
9 | 白球比 | 1.6 | |
10 | 乳酸脱氢酶 | 161 | U/L |
11 | 磷酸肌酸激酶 | 56 | U/L |
12 | 甘油三酯 | 0.52 | mmol/L |
13 | 总胆固醇 | 4.27 | mmol/L |
14 | 高密度脂蛋白胆固醇 | 1.57 | mmol/L |
15 | 低密度脂蛋白胆固醇 | 1.40 | mmol/L |
16 | 葡萄糖 | 4.94 | mmol/L |
【答案】Na2CO3+H2O+CO2=2NaHCO3 0.2mol 6.72 Cl2+2OH=Cl-+ClO-+H2O 2 HCO3-+H+=CO2↑+H2O K2O·Al2O3·6SiO2 0.89g
【解析】
(1)碳酸钠与二氧化碳在溶液中反应生成碳酸氢钠;加热时发生反应:2NaHCO3![]() Na2CO3+H2O+CO2↑,根据生成的二氧化碳可以计算每一份中碳酸氢钠的物质的量,原混合物中碳酸氢钠的物质的量为每一份中碳酸氢钠的2倍,结合原混合物的质量可得原混合物中碳酸钠的质量,再根据碳原子守恒计算每一份与盐酸反应生成二氧化碳的体积;
Na2CO3+H2O+CO2↑,根据生成的二氧化碳可以计算每一份中碳酸氢钠的物质的量,原混合物中碳酸氢钠的物质的量为每一份中碳酸氢钠的2倍,结合原混合物的质量可得原混合物中碳酸钠的质量,再根据碳原子守恒计算每一份与盐酸反应生成二氧化碳的体积;
(2)氯气和NaOH反应生成NaCl和NaClO,根据氯气和转移电子之间的关系式计算转移电子物质的量;
(3)小苏打的主要成分为碳酸氢钠,可与盐酸反应生成二氧化碳气体;
(4)按照活泼金属氧化物较活泼金属氧化物SiO2H2O的顺序来书写;
(5)由表中数据可知葡萄糖的浓度为4.94mmol/L,即1L溶液含有4.94mmol葡萄糖,结合m=nM计算。
(1)碳酸钠与二氧化碳在溶液中反应生成碳酸氢钠,反应方程式为:Na2CO3+H2O+CO2=2NaHCO3;加热生成二氧化碳的物质的量为![]() =0.1mol,由2NaHCO3
=0.1mol,由2NaHCO3![]() Na2CO3+H2O+CO2↑,可知每一份中碳酸氢钠的物质的量为:0.1mol×2=0.2mol,故原混合物中碳酸氢钠的物质的量为0.2mol×2=0.4mol,则原混合物中m(Na2CO3)=54.8g-0.4mol×84g/mol=21.2g,则原混合物中n(Na2CO3)=
Na2CO3+H2O+CO2↑,可知每一份中碳酸氢钠的物质的量为:0.1mol×2=0.2mol,故原混合物中碳酸氢钠的物质的量为0.2mol×2=0.4mol,则原混合物中m(Na2CO3)=54.8g-0.4mol×84g/mol=21.2g,则原混合物中n(Na2CO3)=![]() =0.2mol;每一份中碳酸氢钠为0.2mol,碳酸钠为0.1mol,根据碳原子守恒,可知与盐酸反应生成二氧化碳为:(0.2mol+0.1mol)×22.4L/mol=6.72L,故答案为:Na2CO3+H2O+CO2=2NaHCO3;0.2 mol;6.72;
=0.2mol;每一份中碳酸氢钠为0.2mol,碳酸钠为0.1mol,根据碳原子守恒,可知与盐酸反应生成二氧化碳为:(0.2mol+0.1mol)×22.4L/mol=6.72L,故答案为:Na2CO3+H2O+CO2=2NaHCO3;0.2 mol;6.72;
(2)氯气和NaOH反应生成NaCl和NaClO,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,反应中Cl元素化合价由0价分别变化为+1价、-1价,若有2mol氯气参与该反应,则生成2molNaCl,转移电子的物质的量为2mol,数目为2NA,故答案为:Cl2+2OH=Cl-+ClO-+H2O;2;
(3)小苏打的主要成分为碳酸氢钠,可与盐酸反应生成二氧化碳气体,反应的离子方程式为HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=CO2↑+H2O;
(4)钾的氧化物为K2O,铝的氧化物为Al2O3,硅的氧化物为SiO2,则根据活泼金属氧化物、较活泼金属氧化物、SiO2、H2O的顺序可知,KAlSi3O8可改写为K2OAl2O36SiO2,故答案为:K2OAl2O36SiO2;
(5)由表中数据可知葡萄糖的浓度为4.94mmol/L,即1L溶液含有4.94mmol葡萄糖,则质量为4.94×10-3mol×180g/mol=0.89g,故答案为:0.89。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的非金属性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(4)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
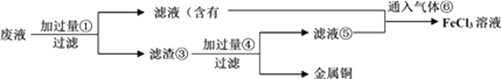
请写出上述实验中加入或生成的有关物质的化学式④____________。
(5)写出向⑤的混合液中通入⑥的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热测定。

(1)写出该反应的热化学方程式[生成1mol H2O(l)时的反应热为-57.3 kJ·mol-1]________________________。
(2)取50mLNaOH溶液和30 mL硫酸溶液进行实验。
①实验数据如下表,温度差平均值为_________
温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1.0 g·mL-1,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则生成1 mol H2O(l)时的反应热ΔH=_____(列出计算式即可,单位为kJ·mol-1)。
③上述实验数值结果大于-57.3 kJ·mol-1,产生偏差的原因不可能是_____
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和BaCO3溶液中存在平衡:BaCO3(s)![]() Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是
Ba2+(aq)+CO32-(aq)。当碳酸钡固体在水中达到溶解平衡后,为使溶液中Ba2+的物质的量浓度增大,下列操作不可行的是
A.加入少量0.1 mol·L-1盐酸B.加入少量硝酸钡固体
C.加入少量0.1 mol·L-1硫酸D.加入少量氢氧化钡固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是______(填字母)。
A 送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B 把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C 把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D 要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) △H=-890 kJ· mol-1
CO2(g)+2H2O(l) △H=-890 kJ· mol-1
②2H2(g)+O2(g)![]() 2H2O(l) △H=-572 kJ· mol-1
2H2O(l) △H=-572 kJ· mol-1
则反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
(3)CO2催化加氢合成二甲醚是CO2转化的-种方法,主要发生下列反应:
反应I:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41.2 kJ· mol-1
CO(g)+H2O(g) △H=+41.2 kJ· mol-1
反应II:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
在一体积为1 L的恒容密闭容器中,充入1 mol CO2与1 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=![]() ×100%。
×100%。
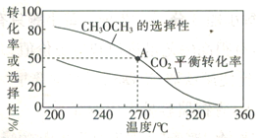
①CH3OCH3的选择性随温度的升高而降低的原因是___________,温度高于300℃时,CO2的平衡转化率随温度的升高而增大的原因是____________。
②270°C时,测得平衡时CH3OCH3的物质的量为0.1 mol,此时n(H2O)=_________mol,反应I的化学平衡常数K=___________(保留两位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1 mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为__________(填“阴极”或“阳极”),生成C2H4的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
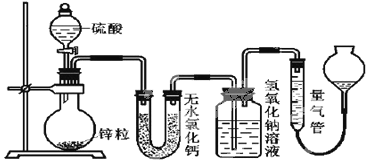
(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是__。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:__。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg。量气瓶中收集到VmL气体,则有:![]() ,依据的原理是___。
,依据的原理是___。
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,![]() =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,![]() 的数值将__(填偏大、偏小或无影响)。
的数值将__(填偏大、偏小或无影响)。
(5)反应结束后,为了准确地测量气体体积,除了待冷却至室温才开始读数外,量气管在读数时还应注意:①___;②___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
(1)酸碱中和滴定——用浓度为0.1000mol·L-1的标准盐酸滴定未知浓度的NaOH溶液,表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.50 | 20.40 |
第二次 | 20.00 | 3.00 | 23.00 |
第三次 | 20.00 | 4.00 | 24.10 |
①下列操作造成测定结果偏高的是________(填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
②该NaOH溶液的物质的量浓度为_____________mol/L。(小数点后保留四位有效数字)
(2)氧化还原滴定——取一定量的草酸(H2C2O4)溶液置于锥形瓶中,加入适量稀硫酸,用标准酸性高锰酸钾溶液滴定。滴定时KMnO4溶液应装在______________(填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaClB.NaBrC.NaCND.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年5月1日上海世博会隆重开幕,受到全世界人们的关注。世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料。聚碳酸酯的结构简式如图所示,下列说法正确的是( )
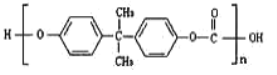
A.它是由一种单体聚合而成的B.它是通过加聚反应得到的产物
C.它是一种纯净物D.它不耐强碱,可发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com