
分析 A、B、C、D四种均含有铝元素的化合物,
已知A可以与NaOH溶液反应生成D和水,则A为氧化铝或氢氧化铝,B分解生成A和水,说明A为Al2O3,则B为Al(OH)3,C+NaOH(适量)=B+NaCl,则C为AlCl3,
AlCl3+D+H2O=B+NaCl,则D为NaAlO2,据此分析.
解答 解:A、B、C、D四种均含有铝元素的化合物,
已知A可以与NaOH溶液反应生成D和水,则A为氧化铝或氢氧化铝,B分解生成A和水,说明A为Al2O3,则B为Al(OH)3,
C+NaOH(适量)=B+NaCl,即C+NaOH(适量)=Al(OH)3+NaCl,则C为AlCl3,
AlCl3+D+H2O=B+NaCl,由元素守恒可知,D为NaAlO2,
故答案为:Al2O3;AlCl3.
点评 本题考查了无机物的推断和铝元素的化合物的性质,题目难度不大,注意把握铝的化合物之间的转化,侧重于考查学生的分析能力.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
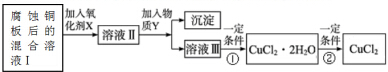
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
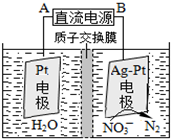 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 氢氧燃料电池的负极通入的是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应为Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时OH-向阳极移动 | |
| C. | 放电时每转移3mole-正极有1molK2FeO4被氧化 | |
| D. | 充电时,电源的正极应与电池的Zn(OH)2极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b极为电池的负极 | |
| B. | 当1mol乙醇被氧化转移12NA个电子 | |
| C. | 电池工作时电流由a极沿导线经灯泡再到b极 | |
| D. | 电池正极的电极反应为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Fe2+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

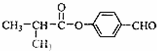 ;
;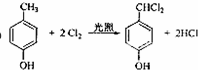 ;
;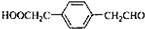 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com