
| A、①比②多 | B、②比①多 |
| C、一样多 | D、无法比较 |
| ||
| ||


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在容量瓶中加一定体积的水,再加入浓盐酸配制准确浓度的稀盐酸 |
| B、蒸馏操作时在蒸馏烧瓶中加入沸石以防止爆沸 |
| C、用玻璃棒搅拌漏斗中的液体以加快过滤的速度 |
| D、加入盐酸以除去硫酸钠中的少量碳酸钠杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
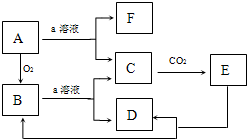 如图物质的转化关系中,A为难熔固体单质,E为一种白色不溶物,a是焰色反应呈黄色的强碱溶液.据此回答:
如图物质的转化关系中,A为难熔固体单质,E为一种白色不溶物,a是焰色反应呈黄色的强碱溶液.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏常用于分离提纯液态有机混合物 |
| B、燃烧法是研究确定有机物成分的有效方法之一 |
| C、核磁共振氢谱通常用于分析有机物的相对分子质量 |
| D、对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,0.1mol?L-1NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大; |
| B、用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| C、电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气; |
| D、对于Al(OH)3(s)?Al(OH)3(aq)?Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡; |
| E、除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3的大; |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用加热的方法除去Na2CO3固体中混有Na2HCO3 |
| B、可向Na2HCO3溶液中通入过量的CO2气体除去其中混有的Na2CO3 |
| C、可用澄清石灰水鉴别Na2HCO3和Na2CO3两种溶液 |
| D、分别向Na2CO3溶液、Na2HCO3溶液中滴加过量的稀盐酸,均有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 焦炭 |
| 高温 |
| HCl |
| 573K以上 |
| 精馏 |
| H2 |
| 1357K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com