
分析 NH4)2CO3发生反应:(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O↑+CO2↑,由方程式可知,1mol(NH4)2CO3分解生成4mol混合气体,4mol混合气体的质量等于1mol(NH4)2CO3的质量,先根据$\frac{M}{n}$=$\frac{{m}_{总}}{{n}_{总}}$计算混合气体的平均摩尔质量,然后利用密度之比等于摩尔质量之比计算,以此解答该题.
解答 解:因(NH4)2CO3发生反应:(NH4)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+H2O↑+CO2↑
方程式可知,1mol(NH4)2CO3分解生成4mol混合气体,4mol混合气体的质量等于1mol(NH4)2CO3的质量,
则混合气平均摩尔质量为=$\frac{1mol×96g/mol}{4mol}$=24g/mol,
因气体密度之比等于摩尔质量之比,所以混合气的密度是相同条件下的氢气密度的$\frac{24g/mol}{2g/mol}$=12倍,
故答案为:12.
点评 本题结合铵盐的化学性质,考查了平均摩尔质量、相对密度的计算等,侧重考查学生的分析能力和计算能力,难度不大,注意基础知识的理解掌握.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1 molCO、2 mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 衡 时 数据 | CH3OH的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | a kJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | a1 | a2 | a3 | |
| A. | 2 c1>c3 | B. | |a|+|b|=90.8 | C. | 2 p2<p3 | D. | a1+a3<1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
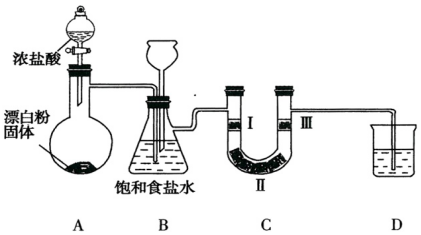
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 15 | C. | 16 | D. | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
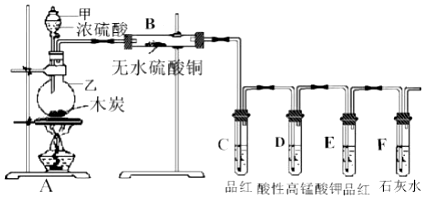
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com