
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
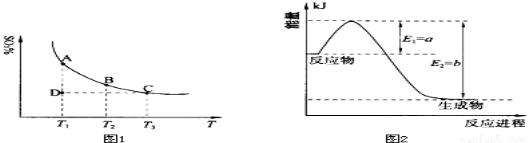
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”,下同)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2?L-2,Ksp[AgI]=1.5×10-16mol2?L-2),在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI 溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(1)① 向左 ② > , >
(2)①N2(g)+3H2(g) 2NH3(g)△H=-2(b-a)kJ?mol-1 (其他合理答案也可给分)
2NH3(g)△H=-2(b-a)kJ?mol-1 (其他合理答案也可给分)
② 10-7b/(a-b)
(3)c(Ag+)(Cl-)大于溶度积Ksp(AgCl), 白色沉淀转化为黄色沉淀 AgCl(s)+I-═AgI(s)+Cl-
【解析】
试题分析:(1)①恒温、恒压条件下,反应达平衡,向体系中通入氦气,容器的容积增大,相当于减小压 强,平衡向气体体积增大的逆向移动,即平衡向左移动;②由图1可知,随着温度的升高,混合体系中SO3的百分含量逐渐减小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动,则该反应正向为放热反应;温度为T1<T2,则反应的平衡常数K1>K2;D点未达平衡,混合体系中SO3的百分含量小于平衡时的百分含量,反应向正反应进行,v正 >v逆;
(2)①由图2可知,N2和H2反应生 成1molNH3放出的热量为(b-a)kJ,该反应的热化学反应方程式为N2(g)+3H2(g) 2NH3(g)△H=-2(b-a)kJ?mol-1;②将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,溶液中c(NH4+)=c(Cl-)=b/2mol/L,反应后c(NH3?H2O)=(a-b)/2mol/L,代入一水合氨电离常数表达式计算得电离常数为10-7b/(a-b);
2NH3(g)△H=-2(b-a)kJ?mol-1;②将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,溶液中c(NH4+)=c(Cl-)=b/2mol/L,反应后c(NH3?H2O)=(a-b)/2mol/L,代入一水合氨电离常数表达式计算得电离常数为10-7b/(a-b);
(3)在25℃下,向0.1L0.002mol?L-1的NaCl溶液中逐滴加入0.1L0.002mol?L-1硝酸银溶液,混合液反应前氯离子和银离子浓度均为0.001mol?L-1,c(Ag+)(Cl-)=1×10-6大于溶度积Ksp(AgCl),有白色沉淀生成;向反应后的浊液中,继续加入0.1L0.002mol?L-1的NaI溶液,由于氯化银和碘化银阴阳离子个数
比相同,溶度积越大,溶解度越大,即AgCl比AgI的溶解度大,根据沉淀转化的方向知,沉淀易向更难溶的方向转化,即由AgCl转化为更难溶的AgI,现象为白色沉淀转化为黄色沉淀,离子方程式为AgCl(s)+I-═AgI(s)+Cl-。
考点:考查化学平衡图像、热化学方程式书写、电离常数计算及沉淀溶解平衡。


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2015届河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:实验题
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液?称量时,样品可放
在________(填编号字母)称量?
A.小烧杯中 B.洁净纸片上 C.托盘上
(2) 滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用____(填编号字母)作指示剂?
A.甲基橙 B.石蕊 C.酚酞
(3)在铁架台上垫一张白纸,其目的是_______ _?
(4)用0.20 mol·L-1的盐酸来滴定10.00 mL待测溶液,滴定终止时消耗盐酸溶液20.00mL,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________?
(5)下列实验操作:将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 (填“偏高”?“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:选择题
控制适宜条件,将反应Sn(s)+Pb2+ (aq) Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )
Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )

A.此时化学反应达到平衡状态
B.若此时将Sn电极换成质量较大的Sn 电极后,电流计指针偏转,c(Pb2+)将减小
C.若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极
D.若此时升高温度,c(Sn2+)将减小,Pb电极为负极
查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:选择题
关于溶液的酸碱性说法正确的是 ( )
A.c(H+)很小的溶液一定呈碱性
B.PH=7的溶液一定呈中性
C.不能使酚酞试液变红的溶液一定呈酸性
D.c(OH-)= C(H+)的溶液一定呈中性
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
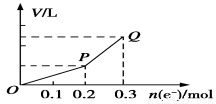
A.0.15 mol CuO B.0.1 mol CuCO3
C.0.075mol Cu(OH)2 D.0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源:2015届江西省赣州市六校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列液体均处于25℃,下列有关叙述正确的是( )
A.PH值相同的盐酸和氯化铵溶液中水的电离程度相同
B.某溶液中由水电离出的c(H+)=10-13,则该溶液的PH一定为13
C.PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的2倍
D.中和浓度和体积均相同的盐酸和醋酸,消耗的氢氧化钠的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高二上学期期末考试化学试卷(解析版) 题型:选择题
在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是
A.Mg(OH)2的溶解度最小 B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小 D.物质Ksp越大溶解度也越大
查看答案和解析>>
科目:高中化学 来源:2015届江苏省扬州市高二下学期学业水平模拟化学试卷(二)(解析版) 题型:填空题
双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯。BPA的结构简式如图所示。
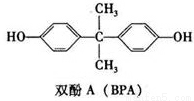
(1)双酚A中的含氧官能团为 (填名称)。
(2)下列关于双酚A的叙述中,不正确的是 (填标号)。
A.遇FeCl3溶液变色
B.可以发生还原反应
C.1 mol双酚A最多可与2 mol Br2反应
D.可与NaOH溶液反应
(3)双酚A的一种合成路线如下图所示:
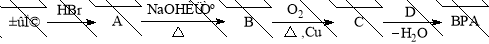
①丙烯→A的反应类型是 。
②B→C的化学方程式是 。
Ⅱ(7分)甲苯和溴乙烷混合物可通过如下流程进行分离。

请填写下列空白:
(1)X的结构简式为 ;
(2)操作①能否用分液 ,理由是 。
(3)写出甲苯与溴乙烷的混合物中加入试剂A时发生反应的化学方程式: 。
(4)如果Y为乙烯,则试剂B为 ,“一定条件”是指 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com