
分析 (1)第一步:对试样进行观察Fe2+ 离子是浅绿色;
第二步:取少量试样配成溶液,为防止配成的溶液出现浑浊,试样应用稀酸溶液配制,抑制铁离子的水解,铁离子水解的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+;
第三步:证明试样中含有Fe2+,先滴加KSCN溶液,无现象,滴加氯水观察到溶液呈红色证明含亚铁离子;
(2)确定该结晶水合物的化学式:
称取两份质量均为 1.96g 的该结晶水合物,分别制成溶液.一份加入足量Ba(OH)2溶液,用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体 2.33g.计算得到含硫酸根离子物质的量,另一份加入含0.001mol KMnO4 的酸性溶液,MnO4- 恰好完全被还原为Mn2+.结合反应的离子方程式计算亚铁离子物质的量,结晶水合物含有两种阳离子(Fe2+ 和NH4+)和一种阴离子(SO42-),依据电荷守恒、质量守恒计算所含铵根离子物质的量和结晶水物质的量,据此计算得到化学式.
解答 解:(1)第一步:对试样进行观察Fe2+ 离子是浅绿色,说明试样中可能含有Fe2+ 存在的外观特征是:固体颜色为浅绿色,
故答案为:固体颜色为浅绿色;
第二步:取少量试样配成溶液,为防止配成的溶液出现浑浊,试样应用稀酸溶液配制,抑制铁离子的水解,铁离子水解的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
第三步:证明试样中含有Fe2+,先滴加KSCN溶液,无现象,滴加氯水观察到溶液呈红色证明含亚铁离子,
故答案为:KSCN溶液;无现象;氯水;溶液变红色;
(2)确定该结晶水合物的化学式:
称取两份质量均为 1.96g 的该结晶水合物,分别制成溶液.一份加入足量Ba(OH)2溶液,用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体 2.33g.计算得到含硫酸根离子物质的量=$\frac{2.33g}{233g/mol}$=0.01mol,另一份加入含0.001mol KMnO4 的酸性溶液,MnO4- 恰好完全被还原为Mn2+.结合反应的离子方程式计算亚铁离子物质的量,
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
1 5
0.001mol 0.005mol
原晶体中含亚铁离子物质的量0.005mol,
依据阴阳离子电荷守恒得n(NH4+)+2n(Fe2+)=2n(SO42-),
n(NH4+)=2×0.01mol-2×0.005mol=0.01mol
所以结晶水合物中水的质量为:1.96g-0.01mol×18g/mol-0.005mol×56g/mol-0.01×96g/mol=0.54g,
n(H2O)=$\frac{0.54g}{18g/mol}$=0.03mol,
所以,1.96g的该结晶水合物中:
n(NH4+):n(Fe2+):n(SO42-):n(H2O)=0.01mol:0.005mol:0.01mol:0.03mol=2:1:2:6,
该结晶水合物的化学式为:(NH4)2Fe(SO4)2•6H2O;[或(NH4)2SO4•FeSO4•6H2O],
故答案为:(NH4)2Fe(SO4)2•6H2O;[或(NH4)2SO4•FeSO4•6H2O].
点评 本题考查离子的检验和推断,题目难度中等,注意从守恒的角度推断结晶水合物的化学式.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
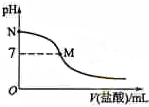 298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )| A. | 该滴定过程应该选择石蕊作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
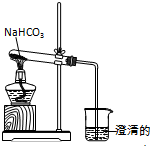 实验室利用图所示装置进行NaHCO3的受热分解实验.
实验室利用图所示装置进行NaHCO3的受热分解实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定等于0.01 | B. | 一定大于0.01 | ||
| C. | 一定大于或等于0.01 | D. | 可能小于0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
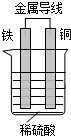 (1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:| 实验序号 | 金属质量 /g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 反应前溶液温度/℃ | 金属消失的时间/s |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C3H4 | C. | C2H4 | D. | C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者燃烧时现象完全相同 | |
| B. | 点燃前都不用验纯 | |
| C. | 甲烷燃烧的火焰呈淡蓝色,乙烯燃烧的火焰较明亮并伴有黑烟 | |
| D. | 二者燃烧时都有黑烟生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com