
【题目】下列有关说法中正确的是( )
A. 主族元素的电负性越大,元素原子的第一电离能一定越大
B. 在元素周期表中,元素电负性从左到右越来越大
C. 金属元素电负性一定小于非金属元素电负性
D. 在形成化合物时,电负性越小的元素越容易显示正价
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,33.6L 氟化氢中含有氟原子的数目为 1.5NA
B. 常温常压下,7.0g 乙烯与丙烯的混合物中含有氢原子的数目为 NA
C. 50mL l8.4mol/L 浓硫酸与足量铜微热反应,生成 SO2 分子的数目为 0.46NA
D. 某密闭容器盛有 0.lmolN2 和 0.3molH2,在一定条件下充分反应,转移电子的数目为 0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”ke牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+NaClO+H2O=NaHCO3+HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。
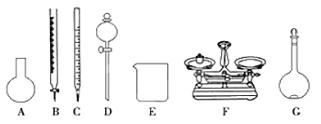
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2Y2-是乙二胺四乙酸根(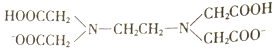 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0
FeY2-(NO)(aq) △H<0
(1)将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是_________。
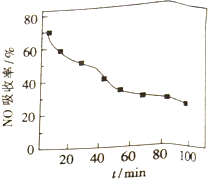
(2)生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理:FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为_______。
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应 | lgK(K为平衡常数) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
①表中最不稳定的金属络合物是_____(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为________(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于________(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为___________________。
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,/span>废水处理效果越好,这是因为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些化学键的键能如下表所示(单位kJ·mol-1):
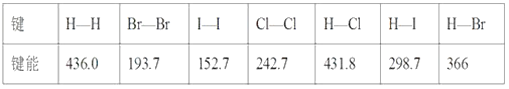
(1)1 mol H2在2 mol Cl2中燃烧,放出的热量为____kJ。
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是________。
A.Cl2>Br2>I2 B.I2>Br2>Cl2
预测1 mol H2在足量F2中燃烧比在足量Cl2中燃烧放热________________(填“多”或“少”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是

A. Pt电极上发生还原反应
B. 随着使用,电解液的pH逐渐减小
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)当H2O和H2O2分子个数比为1:1 时,原子总数之比为_____________,电子数之比为________________。
(2)V mLAl2(SO4)3溶液中含a gAl3+,取出V/4 mL溶液稀释成V mL后,SO42-的物质的量浓度为______________(用含a、V的代数式表示,化简到最简整数比)。
(3)在一定条件下,11.2 g单质R与0.3 molCl2完全反应,生成0.2 molRClx,则x=______,RClx 的摩尔质量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如下实验装置制备少量的漂白粉。回答下列问题:
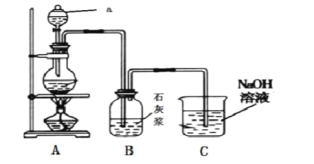
(1)漂白粉的有效成分是__________________(填化学式)。
(2)仪器a的名称是____________,用二氧化锰和浓盐酸制取氯气的化学方程式为MnO2 + 4HCl (浓)![]() MnCl2 + Cl2 ↑+ 2H2O 该反应中氧化剂与还原剂的物质的量之比为 ________________。
MnCl2 + Cl2 ↑+ 2H2O 该反应中氧化剂与还原剂的物质的量之比为 ________________。
(3)装置B发生反应的化学方程式为___________________________________。
(4)装置C的作用是___________,C中发生反应的离子方程式为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com