
【题目】科学研究与工业生产中常常用到溶液中的反应。
(1)25℃时,0.05 mol·L-1Ba(OH)2溶液的pH= ,将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7,则Ba(OH)2溶液与HCl溶液的体积比为 。
(2)CO2可转化成有机物实现碳循环:CO2![]() CH3OH
CH3OH![]() HCOOH……
HCOOH……
25 ℃时,几种酸的电离平衡常数如下:
化学式 | HCOOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
①用离子方程式表示HCOONa溶液呈碱性的原因 。
②物质的量浓度均为0.1 mol·L-1的下列四种物质:
a.Na2CO3 b.NaClO c.HCOONa d.NaHCO3 ,pH由大到小的顺序是 (填编号)。
(3)常温下,将0.2 mol·L-1的HCOOH和0.1 mol·L-1的NaOH溶液等体积混合,所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度 HCOONa的水解程度(填“大于”“等于”或“小于”)。
(4)含有Cr2O72-的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O72-。为使废水能达标排放,做如下处理:Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
Cr(OH)3、Fe(OH)3。若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为 mol·L-1 (已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。
【答案】(1)13 1:10
(2)①HCOO-+H2O![]() HCOOH+OH- ②a>b>d>c
HCOOH+OH- ②a>b>d>c
(3)大于 (4)3×10-6
【解析】
试题分析:(1)25℃时,0.05 mol·L-1Ba(OH)2溶液中从c(OH-)=0.1mol/L,则c(H+)=10-13mol/L, pH=13;pH=2的HCl溶液中,c(H+)=0.01mol/L,所以将该Ba(OH)2溶液与pH=2的HCl溶液混合,若所得混合溶液pH=7时,则Ba(OH)2溶液与HCl溶液的体积比为1:10。
故答案为:13;1:10;
(2)①HCOONa为强碱弱酸盐,在溶液中存在HCOO-+H2O![]() HCOOH+OH-,破坏了水的电离平衡,使溶液呈碱性。
HCOOH+OH-,破坏了水的电离平衡,使溶液呈碱性。
故答案为:HCOO-+H2O![]() HCOOH+OH-;
HCOOH+OH-;
②依据电离平衡常数可知,酸性HCOOH>H2CO3>HClO>HCO3-,所以碱性a>b>d>c,溶液的pH a>b>d>c。
故答案为:a>b>d>c;
(3)酸的物质的量是碱的物质的量的2倍,且酸碱都是一元的,反应后生成等物质的量的HCOOH和HCOONa,由于所得溶液的pH<7,说明所得混合溶液中HCOOH的电离程度大于HCOONa的水解程度。
故答案为:大于;
(4)某工厂废水中含5.00×10-3 molL-1的Cr2O72-,n(Cr2O72-)=10L×5.00×10-3mol/L=5.00×10-2mol,依据氧化还原反应离子方程式:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,若处理后的废水中残留的c(Fe3+)=2×10-13molL-1,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25mol/L,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=6.0×10-31 ,c(Cr3+)=3×10-6molL-1。
故答案为:3×10-6。


科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
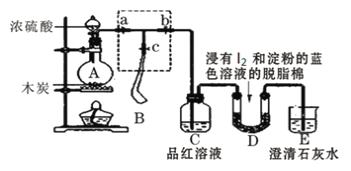
(1)装置A中盛放浓硫酸的仪器名称______________。
(2)装置A中发生反应的化学方程式为___________________________________。
(3)实验时,装置C中的现象为_______________________________________。
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是_________________(用操作编号填写)。
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(5)当D中产生_________________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;写出D中发生反应的化学方程式_______________________________________,当D中反应发生0.3mol电子转移时,发生反应的气体的体积(标准状况)是_____________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
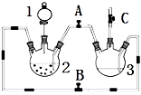
(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关B,打开开关A,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
i滴定过程中发生反应的离子方程式为
ii滴定终点的现象是
iii通过实验数据计算的该产品纯度为 (用字母a,c表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
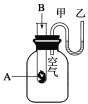
(1)该反应为____________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量____________(填“高”或“低”)。
(3)物质中的化学能通过______转化成______释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)若甲烷的燃烧热为890KJ/mol,请写出表示甲烷燃烧热的热化学方程式__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示。反应进行的前5 min内,v(H2)= ;10 min时,改变的外界条件可能是 。
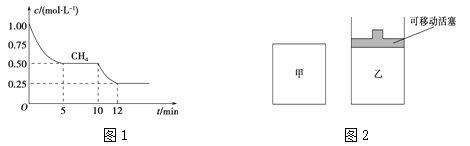
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。
①可以判断甲容器中反应已达平衡状态的是 。
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 。
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)= P (乙)
(3)反应③中ΔH3= kJ·mol-1。800 ℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系是 (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中含有苯酚,实验操作是___________________________________________________。从废水中回收苯酚的方法是:①取有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚从有机溶剂中脱离;③通入某物质又析出苯酚。试写出②、③步的化学方程式__________。
(2)某醛的结构简式为 
检验分子中醛基的所用的试剂是________________,化学方程式为____________;然后往反应后的溶液中加入稀硫酸至溶液呈酸性,再滴加足量的溴水,检验分子中碳碳双键,生成的有机产物的结构简式是____________;
(3)做过银镜反应的试管内壁的一层银,可用_________除去。(写化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com