
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
(1)参照下图 B、F 元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出 C、N、O 三 种元素的相对位置。

(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为_________________ 。
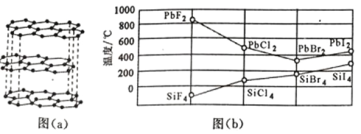
(3)二卤化铅 PbX2 的熔点如图(b)所示,可推断:依 F、Cl、Br、I 次序,PbX2 中的化学键 的离子性_____( 填“增 强”、“ 不变”或“减弱”, 下 同 ), 共价性_____。
(4)NH3 和 F2 在 Cu 催化下可发生反应 4NH3+3F2 ![]() NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
NF3+3NH4F,化学方程式中的 5 种物质所属的晶体 类型有_____(填序号)。写出基态铜原子的价电子排布式_____。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3 与一定量水形成(H2O)2·BF3 晶体 Q,Q 在一定条件下可转化为 R: 晶体 R 中含有的化学键包 括_____。
晶体 R 中含有的化学键包 括_____。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的 Ka2____________________________苯酚
,相同温度下,水杨酸的 Ka2____________________________苯酚
(![]() )的 Ka(填“>”“ =”或“<”),其原因是______________。
)的 Ka(填“>”“ =”或“<”),其原因是______________。
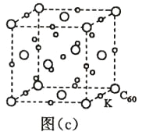
(7)碳的另一种单质 C60 可以与钾形成低温超导化合物,晶体结构如图(c)所示,K 位于立方体的棱上和 立方体的内部,此化合物的化学式为____________;其晶胞参数为 1.4 nm,阿伏加德罗常数用 NA 表 示,则晶体的密度为________________g·cm-3。(只需列出式子)
【答案】sp2减弱增强abd3d104s1离子键、共价键、配位键<![]() 中形成分子内氢键,使其更难电离出 H+K3C60
中形成分子内氢键,使其更难电离出 H+K3C60![]()
【解析】
(1)根据同周期从左到右元素的第一电离能呈增大的趋势。N的价电子排布为2s22p3.,呈半充满状态比较稳定,所以第一电离能有小到大的排列为:B<C<O<N<F,所以答案为:
(2)由碳的一种单质的结构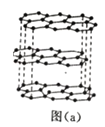 如图(a)所示,知该单质为石墨,石墨属于混合晶型,根据图a知每个碳原子形成3
如图(a)所示,知该单质为石墨,石墨属于混合晶型,根据图a知每个碳原子形成3![]() 键,碳原子上没有孤对电子,碳原子的杂化轨道类型为sp2杂化。答案为:sp2。
键,碳原子上没有孤对电子,碳原子的杂化轨道类型为sp2杂化。答案为:sp2。
(3)二卤化铅 PbX2 的熔点图 所示,由图可知PbX2 的熔点依 F、Cl、Br、I 次序,先减小后增大,同主族由上到下元素的非金属性逐渐减弱,说明PbX2 依 F、Cl、Br、I 次序,PbX2中的化学键的离子性逐渐减弱,共价性逐渐增强。答案:减弱 增强。
所示,由图可知PbX2 的熔点依 F、Cl、Br、I 次序,先减小后增大,同主族由上到下元素的非金属性逐渐减弱,说明PbX2 依 F、Cl、Br、I 次序,PbX2中的化学键的离子性逐渐减弱,共价性逐渐增强。答案:减弱 增强。
(4)NH3 、NF3属于共价化合物,而 F2 属于非金属单质,所以NH3 、NF3、F2属于分子晶体,NH4F属于离子化合物,属于离子晶体, Cu 属于金属是金属晶体,所以4NH3+3F2 ![]() NF3+3NH4F,化学方程式中的 5 种物质所属的晶体类型有abd,答案:abd,。铜属于29号元素,核外有29个电子,所以基态铜原子的电子排布式为1s22s22p63s23p63d104s1,基态铜原子的价电子排布式3d104s1。
NF3+3NH4F,化学方程式中的 5 种物质所属的晶体类型有abd,答案:abd,。铜属于29号元素,核外有29个电子,所以基态铜原子的电子排布式为1s22s22p63s23p63d104s1,基态铜原子的价电子排布式3d104s1。
(5)根据R的结构,R中阴阳离子间为离子键, 中的阴、阳离子中都存在着共价键和配位键,故晶体R中含有的化学键为离子键、共价键、配位键。答案:离子键、共价键、配位键。
中的阴、阳离子中都存在着共价键和配位键,故晶体R中含有的化学键为离子键、共价键、配位键。答案:离子键、共价键、配位键。
(6)因为 ![]() 中可形成分子内氢键,使其更难电离出H+,所以相同温度下,水杨酸的Ka2小于
中可形成分子内氢键,使其更难电离出H+,所以相同温度下,水杨酸的Ka2小于![]() 的Ka。答案:<
的Ka。答案:< ![]() 中形成分子内氢键,使其更难电离出 H+ 。
中形成分子内氢键,使其更难电离出 H+ 。
(7) 用均摊法求解。由图中信息可知,1个晶胞中含K的数目为12![]() +9=12,含 C60的数目为8
+9=12,含 C60的数目为8![]() +6
+6![]() =4,K与C60的个数比为12:4=3:1,故此化合物的化学式为K3C60。1个晶胞的体积为 (1.4nm)3=1.43
=4,K与C60的个数比为12:4=3:1,故此化合物的化学式为K3C60。1个晶胞的体积为 (1.4nm)3=1.43![]() 10-21cm3,1mol晶胞的体积为1.43
10-21cm3,1mol晶胞的体积为1.43![]() 10-21
10-21![]() NAcm3;该化合物1mol晶胞中含4mol K
NAcm3;该化合物1mol晶胞中含4mol K![]() 837g,所以晶体的密度为
837g,所以晶体的密度为![]() 。
。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是
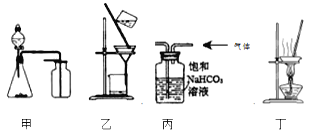
A. 选择合适的试剂,用图甲可分别制取少量CO2、CO和SO2
B. 洗涤沉淀时(见图乙),向漏斗中加入适量水至浸没沉淀并滤干,重复2-3次
C. 用图丙所示装置除去HCl中的少量CO2
D. 用图丁装置从KI和I2的固体混合物中回收I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 的分子式均为 C8H8,下列说法正确的是
的分子式均为 C8H8,下列说法正确的是
A. a、b、c 均可与酸性高锰酸钾溶液反应
B. a、b、c 的二氯代物均只有 3 种
C. a 的同分异构体中除 b、c 外,还有可与溴水反应的物质
D. a、b、c 中只有 b、c 的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙炔的说法不正确的是( )
A.燃烧时有浓厚的黑烟
B.实验室制乙炔时可用CuSO4除杂质气体
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替
D.乙炔的收集方法可用排空气法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料,其制备工艺流程如下图所示:
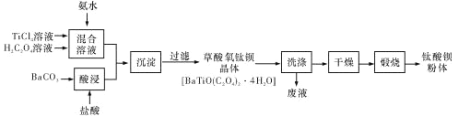
(1)镁的碳化物常见的有MgC2和Mg2C3两种,它们均极易与水发生反应。写出MgC2发生水解反应的化学方程式:_____;Mg2C3的电子式为_____。
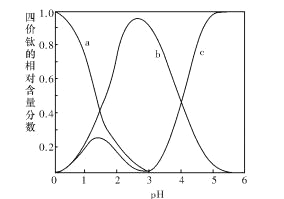
(2)“混合溶液”环节,钛元素在不同pH下主要以种形式存在,如上图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则上图中曲线a对应钛的形式为______填化学符号);写出“沉淀”时的离子方程式:_____。
(3)草酸氧钛钡晶体经蒸馏水数次洗涤后,证明它已被洗涤干净的实验方案为_____。
(4)工业上TiCl4和BaCO3通常用如下方法制备:
①先将金红石(TiO2)与过量焦炭混合,再通入Cl2)并加热到900℃制取TiCl4。请写出该法制备TiCl4的化学方程式:_____。
②BaCO3是将重晶石(主要成分为BaSO4)浸泡在Na2C03溶液中足够长时间来制备。请问Na2CO3溶液的浓度至少要大于_____mol/L才能开始转化。(已知常温下:![]()
![]() ,略CO32-的水解)。
,略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 20gD2O与20g氖气所含有的电子数相同
B. 标准状况下,22.4L二氯甲烷的分子数约为NA
C. 常温常压下,100g 17%的双氧水溶液中含有氧原子总数为NA
D. 56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验制备2-羟基-4-苯基丁酸乙酯,反应原理、装置和数据如下:
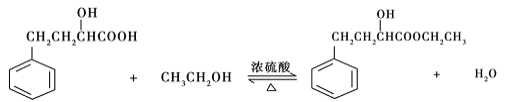
相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
乙醇 | 46 | 0.789 | 78.4 | 易溶 |
2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
实验步骤:
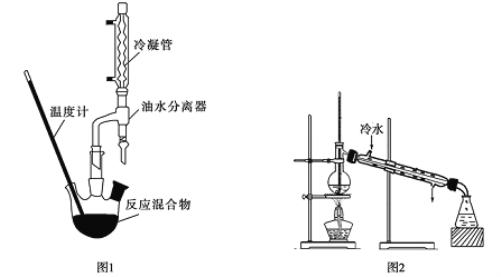
①如图1,在干燥的圆底烧瓶中加入20mL2-羟基-4-苯基丁酸、20mL无水乙醇和适量浓硫酸,再加入几粒沸石;
②加热至70℃左右保持恒温半小时;
③分离、提纯三颈瓶中的粗产品,得到有机粗产品;
④精制产品。
请回答下列问题:
(1)油水分离器的作用为____________________。实验过程中发现忘记加沸石该如何操作_______________________。
(2)本实验采用____________加热方式(填“水浴”、“油浴”或“酒精灯加热”)。
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液和水洗涤。第二次水洗的目的是___________________。
(4)在精制产品时,加入无水MgSO4的作用为___________________;然后过滤,再利用如图2装置进行蒸馏纯化,图2装置中的错误有__________________________。
(5)若按纠正后的操作进行蒸馏纯化,并收集212℃的馏分,得2-羟基-4-苯基丁酸乙酯约9.0g。则该实验的产率为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com