
分析 ①同温同压下,相同体积的任何气体的物质的量相同,故质量之比等于摩尔质量之比;
②在同温同压下,相同质量的气体的体积之比与摩尔质量成反比,体积之比等于物质的量之比;
③在相同状态下,气体的密度之比等于摩尔质量之比;
④根据n=$\frac{V}{Vm}$计算混合气体总物质的量,根据M=$\frac{m}{n}$计算混合气体的平均摩尔质量,令O2和O3的物质的量分别为xmol、ymol,根据二者总物质的量、总质量列方程计算.
解答 解:①同温同压下,相同体积的任何气体的物质的量相同,即在同温同压下相同体积的CH4、O2、O3三种气体的物质的量之比为1:1:1,质量之比等于摩尔质量之比,故质量之比为16:32:48=1:2:3,
故答案为:1:2:3,1:1:1;
②在同温同压下,相同质量的气体的体积之比与摩尔质量成反比,故相同质量CH4、O2、O3三种气体的体积之比等于3:2:1,而体积之比等于物质的量之比,故物质的量之比也为3:2:1,
故答案为:3:2:1;3:2:1;
③在相同状态下,气体的密度之比等于摩尔质量之比,故氢气和氧气的密度之比等于2:32=1;16,
故答案为:1:16;
④混合气体的总物质的量n=$\frac{V}{Vm}$=$\frac{3.36L}{22.4L/mol}$=0.15mol,故平均相对分子质量即平均摩尔质量M=$\frac{m}{n}$=$\frac{5.7g}{0.15mol/L}$=38g/mol,令O2和O3的物质的量分别为xmol、ymol,根据物质的量共有0.15mol,则得:x+y=0.15mol ①;
根据质量共为5.7g,可有:32x+48y=5.7g ②;
解①②两式可得:x=0.05625mol
则氧气的质量m=nM=0.05625mol×32g/mol=1.8g,故氧气在混合气体中的质量分数=$\frac{1.8g}{5.7g}$×100%=31.6%,
故答案为:38;31.6%.
点评 本题考查了阿伏伽德罗定律和常用化学计量的有关计算,侧重对基础知识的考查,注意对公式的理解与灵活运用,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL-1 | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL-1 | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL-1 | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子中含有羧基,可与Na2CO3溶液反应生成CO2 | |
| B. | 淀粉和纤维素都属于高分子化合物 | |
| C. | 苯不能使酸性高锰酸钾褪色 | |
| D. | 苯分子中不存在碳碳双键所以不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. |  图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  图表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 | |
| D. |  图是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 热化学方程式 | 结 论 | |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol | 氢气的燃烧热△H=-483.6 kJ/mol |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.3 kJ/mol | 含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C. | 2C(s)+2O2(g)═2CO2(g)△H=-a kJ/mol 2C(s)+O2(g)═2CO(g)△H=-b kJ/mol | b>a |
| D. | C (石墨,s)═C (金刚石,s)△H=+1.5 kJ/mol | 金刚石比石墨稳定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
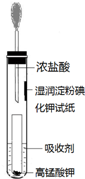 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4查看答案和解析>>
科目:高中化学 来源: 题型:推断题
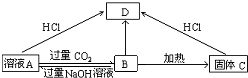
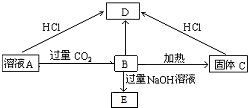
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com