
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 E.降低温度 |
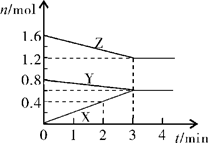
 3X;(2) 0.1;(3)在此条件下该反应已达到反应限度(化学平衡)。
3X;(2) 0.1;(3)在此条件下该反应已达到反应限度(化学平衡)。  3X。
3X。 。
。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.向等体积的20%的H2O2溶液和10%的H2O2溶液中分别滴加等体积的0.1mol?L—1 FeCl3溶液和0.1 mol?L—1CuCl2溶液,前者产生气泡快,这个实验可以充分证明催化剂具有选择性 |
| B.利用水解反应可以制取某些无机化合物如TiO2、SnO2等 |
| C.将0.1 mol?L—1醋酸加水稀释,溶液中各离子浓度均减小 |
| D.室温下同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加A的物质的量 | B.升高体系的温度 |
| C.减少C的物质的量 | D.增加体系的压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是
?2B(g)+C(g) ⊿H> 0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是| A.减压 | B.降温 | C.加压 | D.增大B的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.对该反应体系加热 | B.加入硝酸铜固体 |
| C.改用粗锌 | D.不用锌片,改用锌粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.改用98%的浓硫酸 | B.改用铝粉 |
| C.改加入2 mol/L的稀硫酸100 mL | D.加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使用催化剂可以增大正反应速率,减小逆反应速率 |
| B.使用催化剂可以使化学平衡向正反应方向移动 |
| C.使用催化剂可以降低反应的活化能 |
| D.使用催化剂可以改变反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


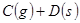 正反应速率加快的是( )
正反应速率加快的是( )| A.减少C或D的物质的量 | B.体积不变充入氦气使压强增大 |
| C.减少B的物质的量 | D.增大A或B的物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
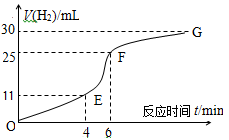
 (OE)、
(OE)、 (EF)、
(EF)、 (FG)表示)哪个最快______________;
(FG)表示)哪个最快______________;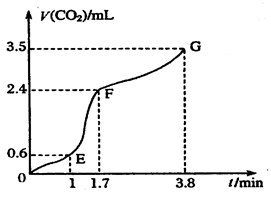
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com