
【题目】用蒸馏水逐步稀释0.2mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-)B.c(NH4+)
C.![]() D.c(NH3·H2O)
D.c(NH3·H2O)
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】某课题组的同学在实验室利用现代先进仪器,获得了某有机物R的相关图谱如下:

回答下列问题:
(1)上图中,甲为_____图,获得该图谱所使用的仪器名称为_______;乙为_____图,获得该图谱所使用的仪器名称为__________________。
(2)已知R属于醇类物质
①结合图谱信息可推知R为 ___________(写名称),写出其与金属钠反应的化学方程式:________________。
②该有机物R_______(填“有”或“无”)同分异构体(不考虑立体结构),若有,请写出其同分异构体的结构简式:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比亚迪公司开发了锂钒氧化物二次电池。电池总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A.该电池充电时,锂电极与外加电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时,阴极的反应为LixV2O5-xe-=V2O5+xLi+
D.若放电时转移0.2mol电子,则消耗锂的质量为1.4xg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中正确的是( )
A.Na2S的水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
B.NaHCO3的电离:NaHCO3![]() Na++H++CO32-
Na++H++CO32-
C.HSO3-的电离:HSO3-![]() H++SO32-
H++SO32-
D.硫氢化钠溶液呈碱性:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家经过研究发现,CO2 与 H2 在催化剂作用下可转化成 CH3OH 燃料,是一种减排、环保的有效方法。该可 逆反应发生过程中的能量变化如图所示,下列说法错误的是

A.CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g)为吸热反应
CO2(g)+3H2(g)为吸热反应
B.使用催化剂 x 时,正反应的活化能 = △H + 逆反应活化能
C.其他条件一定,与其他催化剂相比,使用催化剂 z 时,反应物 转化率可能更高
D.从图中可知,选用不同的催化剂,反应的△H也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。请回答下列问题:
(1)已知:①C2H6 (g)![]() C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
C2H4 (g)+H2(g)ΔH1 =+136.8kJ/mol
②H2 (g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol
③ C2H4(g)+3O2(g)![]() 2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
2CO2(g)+2H2O(l); ΔH3= -1411.0 kJ/mol
则表征 C2H6 (g)燃烧热的热化学方程式为_____。
(2)1000℃时,在某刚性容器内充入一定量的 C2H6 ,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙 烷的平衡转化率为 40%。
①乙烷分解前容器压强为_____Pa ,1000℃时,反应①的平衡常数 Kp=_____Pa[气体分压(P 分)=气体 总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_____40%(填“>”、“<” 或“=”)。
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol,
① 反应 C2H6 (g)+![]() O2(g)
O2(g)![]() C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
C2H4 (g)+H2O(g)ΔH =-149 kJ/mol的正活化能和逆活化能中较大的是________。
② 800℃时,控制原料气的总物质的量一定,当 C2H6 和 O2 的物质的量之比为 2:1 时,乙烯的平衡产率最大,而当![]() 较小时,乙烯的平衡产率较低,可能的原因为_____。
较小时,乙烯的平衡产率较低,可能的原因为_____。
(4)利用电解法可将 C2H6 转化为多种燃料,原理如图所示。铜电极为_____极,该电极上生成 HCOOH 的电极反 应式为_____。
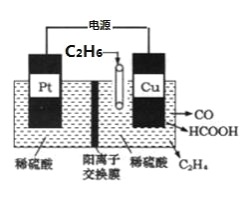
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化石墨烯基水凝胶是一类新型复合材料,常用 Hummers 法制备氧化石墨烯,具体方法为:将石墨粉和无水 NaNO3 混合后置于浓硫酸中并用冰浴冷却,再用 KMnO4 溶液进行氧化处理,最后用 H2O2 处理即可得到氧化石墨烯。请回 答下列问题。
(1)锗(Ge)元素与碳元素同族,基态 Ge 原子的外围电子排布式是_____。与锗同周期且基态原子未成对 电子数与 Ge 原子相同的元素有_____(用元素符号表示)。
(2)对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:
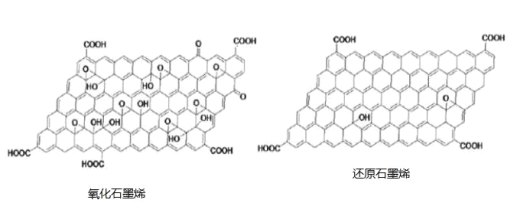
①还原石墨烯中碳原子的杂化形式是___________________ 。
②二者当中在水溶液中溶解度更大的是____________ (填物质名称),原因为__________________。
(3)NaNO3 中 NO3- 的空间构型为_____,写出两种与 NO3- 的互为等电子体的分子的分子式_____。
(4)金属钾晶体和金属锰晶体的三维空间堆积方式均为体心立方堆积。
①上述两种晶体原子在二维平面放置方式均为_____(填“密置层”或“非密置层”)。
②金属钾和金属锰的熔点分别为 63℃和 1244℃,金属锰的熔点高于金属钾熔点的原因为___________。
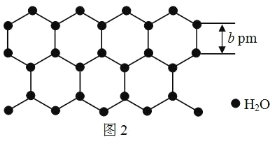
(5)中国科学家首次证明了二维冰的存在,二维冰是由两层六角冰无旋转堆垛而成,两层之间靠氢键连接,每个水分子与面内水分子形成三个氢键,与面外水分子形成一个氢键,二维冰结构的模型示意图的侧视图 如图 1 所示,厚度为 a pm,俯视图如图 2 所示,距离最近的两个水分子间的距离为 b pm,设阿伏加德罗常 数的值为 N,二维冰的密度是________________ g·cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
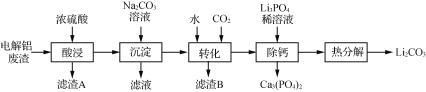
【题目】Li2CO3是生产锂电池的重要原料,电解铝废渣(主要含AlF3、LiF、NaF、CaO等物质)可用于制备Li2CO3。
已知:①Li2CO3的溶解度:0 ℃ 1.54 g;20 ℃ 1.33 g;80 ℃ 0.85 g。
②20 ℃,Ksp[Ca3(PO4)2]=2×10-33,Ksp(CaHPO4)=1×10-7。
(1)在加热条件下酸浸,反应生成能腐蚀玻璃的气体,写出AlF3发生反应的化学方程式:______。

(2)滤渣B的主要成分是________。
(3)“转化”后所得LiHCO3溶液中含有的Ca2+需要加入Li3PO4除去。除钙步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如右图所示。
①随着温度升高最终Li2CO3的产率逐渐减小的原因是___________。
②当温度高于50 ℃时,除钙率下降的原因可能是__________________。
(4)热分解后,获得Li2CO3需趁热过滤的原因是_______________________。
(5)将酸浸时产生的气体通入Al(OH)3和Na2SO4溶液的混合物中可产生难溶物冰晶石(Na3AlF6),该反应的离子方程式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com