
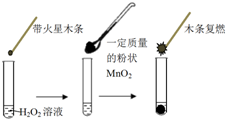
 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
分析 (1)要证明MnO2是H2O2分解反应的催化剂,必须证明催化剂在反应前后的性质和质量不改变;
(2)根据表格中数据,二氧化锰质量的增加,相同时间内收集到氧气的体积也相应增加,说明反应速率加快,从而得出结论;
(3)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡的快慢不一样,说明不同催化剂对反应的催化效果不一样,要对比Fe3+和Cu2+对H2O2分解反应的催化效果,必须排除溶液中的阴离子是否有催化作用,试管Ⅲ就很好的解决了这个问题;
(4)①根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式;
②二价锰、二价铁和一价铜都是化合价降低得到的,说明二氧化锰、Fe3+、Cu2+得到电子,作氧化剂,将双氧水氧化,还原得到的二价锰、二价铁和一价铜又被双氧水氧化成二氧化锰、Fe3+、Cu2+.
解答 解:(1)要证明MnO2是H2O2分解反应的催化剂,必须证明催化剂在反应前后的性质和质量不改变,而甲同学没有做这方面的实验,所以不能达到目的,
故答案为:不能;因为没有确认MnO2的质量和性质是否改变;
(2)根据表格中数据,在一定质量范围内,二氧化锰质量的增加,相同时间内收集到氧气的体积也相应增加,说明反应速率加快,原因是在一定质量范围内,固体质量越大,其表面积也越大,故反应速率加快,催化效果更好,
故答案为:在一定质量范围内,MnO2质量越大,反应速率越快;固体质量越大,其表面积也越大,故反应速率加快,催化效果更好;
(3)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡是试管Ⅰ快,试管Ⅱ慢,试管Ⅲ无气泡产生,试管Ⅲ是一个对比实验,说明Cl-对H2O2的分解没有催化作用,从而得到Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好的结论,
故答案为:Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好;对比实验,证明Cl-对H2O2的分解没有催化作用;
(4)①根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式,FeCl3和H2O2反应,FeCl3中铁元素化合价降低,生成氯化亚铁,双氧水中氧元素化合价升高,生成氧气,方程式为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl;FeCl3作催化剂,在第二个反应中重新生成,氯化亚铁又被双氧水氧化成氯化铁,方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O,
故答案为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl 2FeCl2+H2O2+2HCl=2FeCl3+2H2O;
②二价锰、二价铁和一价铜都是化合价降低得到的,说明二氧化锰、Fe3+、Cu2+得到电子,作氧化剂,将双氧水氧化,还原得到的二价锰、二价铁和一价铜又被双氧水氧化成二氧化锰、Fe3+、Cu2+,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂,
故答案为:H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂.
点评 本题考查了催化剂在反应中起到的作用,以及催化剂的质量大小对反应速率的影响探究,并考查了对比实验的重要性,结合催化剂的特点分析催化机理,并对方程式进行推导,综合性较强.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.
化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 接触法制备硫酸主要的设备有沸腾炉、合成塔和吸收塔 | |
| B. | 工业制备硫酸中,尾气二氧化硫使用NaOH溶液吸收的 | |
| C. | 工业制备硫酸中,三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使三氧化硫吸收完全 | |
| D. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
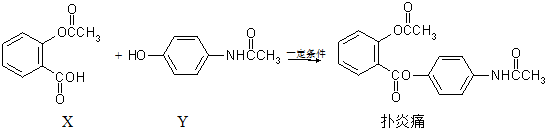
| A. | 扑炎痛的分子式为C17H16NO5 | |
| B. | 可用FeCl3溶液检验扑炎痛中是否含有化合物Y | |
| C. | 扑炎痛在酸性条件下水解最终可以得到3种物质 | |
| D. | 1 mol扑炎痛与足量的NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
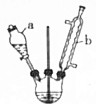 己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:
己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下: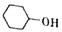 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH3 | B. | 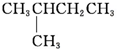 | C. |  | D. | 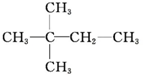 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com