
 碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.
碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.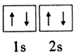 ;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).
;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).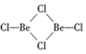 )的形式存在,在1000℃,氯化铍则以BeCl2形式存在.
)的形式存在,在1000℃,氯化铍则以BeCl2形式存在.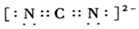 .
.分析 (1)Be是碱土族金属,在周期表中位于第二周期,IIA族,其核外电子排布式为1s22s2;Mg为碱土族金属,位于周期表中第三周期,IIA族,核外电子排布式为1s22s22p63s2,Al位于周期表中第三周期,第IIIA族,核外电子排布式为1s22s22p63s23p1,Al失去第二个电子比Mg要困难;
(2)500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在,在1000℃,氯化铍则以BeCl2形式存在,
①二聚体结构式为 ,Be与Cl成三个键,因此Be的杂化方式为sp2,Cl的最外层含有1个单电子,最多形成1根共价键,则另外一根键为配位键;
,Be与Cl成三个键,因此Be的杂化方式为sp2,Cl的最外层含有1个单电子,最多形成1根共价键,则另外一根键为配位键;
②BeCl2与AlCl3相似,均为分子晶体,MgCl2是离子晶体,离子晶体的熔沸点比分子晶体高;
(3)对于SrF2和BaF2,Ba2+的半径大于Sr2+,二者均为碱土族金属,因此BaF2的阴阳离子半径差别比SrF2更大;
(4)①求粒子的等电子体常采用的方法是上下左右平移元素,同时调电子数,因此与CN22-互为等电子体的分子还有CO2,根据CO2的电子式,写出$C{N}_{2}^{2-}$的电子式;
②CaCN2与水反应生成CaCO3和NH3两种物质,反应方程式为:CaCN2+3H2O=CaCO3+2NH3,1molCaCN2与3molH2O反应,据此判断断裂反应物的σ键数量;
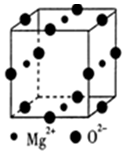
(5)立方晶胞顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,棱上粒子占$\frac{1}{4}$,根据晶胞计算粒子数,再根据电中性原理求解该晶体的化学式;根据晶体密度计算公式:$ρ=\frac{z{M}_{r}}{{N}_{A}V}$求解,其中z为粒子个数,Mr为粒子相对质量,V为一个晶胞体积.
解答 解:(1)Be在周期表中位于第二周期,IIA族,其核外电子排布式为1s22s2,则其基态原子的轨道表示式为 ;Mg位于周期表中第三周期,IIA族,核外电子排布式为1s22s22p63s2,Al位于周期表中第三周期,第IIIA族,核外电子排布式为1s22s22p63s23p1,Al在失去一个电子之后,剩下的是相对稳定结构,再失去电子比Mg要困难,因此第二电离能:I2(Mg)<I2(Al).
;Mg位于周期表中第三周期,IIA族,核外电子排布式为1s22s22p63s2,Al位于周期表中第三周期,第IIIA族,核外电子排布式为1s22s22p63s23p1,Al在失去一个电子之后,剩下的是相对稳定结构,再失去电子比Mg要困难,因此第二电离能:I2(Mg)<I2(Al).
故答案为: ;<;
;<;
(2)①500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在,结构式为 ,Be与Cl成三个键,因此Be的杂化方式为sp2;Cl的最外层含有1个单电子,最多形成1根共价键,则另外一根键为配位键,根据结构式,其中有2个Cl存在配位键,因此1molBe2Cl4存在2mol配位键,
,Be与Cl成三个键,因此Be的杂化方式为sp2;Cl的最外层含有1个单电子,最多形成1根共价键,则另外一根键为配位键,根据结构式,其中有2个Cl存在配位键,因此1molBe2Cl4存在2mol配位键,
故答案为:sp2;2;
②Be和Al处于对角线位置,二者性质相似,BeCl2与AlCl3相似,均为分子晶体,MgCl2是离子晶体,离子晶体的熔沸点比分子晶体高,因此MgCl2的熔、沸点比BeCl2高的原因是MgCl2是离子晶体,而BeCl2是分子晶体.发生状态变化时,离子晶体要克服离子键,分子晶体要克服分子间作用力.离子键比分子间作用力强得多,
故答案为:MgCl2是离子晶体,而BeCl2是分子晶体.发生状态变化时,离子晶体要克服离子键,分子晶体要克服分子间作用力.离子键比分子间作用力强得多;
(3)根据巴索洛规则:一般来讲,盐中阴、阳离子半径相差较大时,其溶解度较大,对于SrF2和BaF2,Ba2+的半径大于Sr2+,二者均为碱土族金属,因此BaF2的阴阳离子半径差别比SrF2更大,因此在水中溶解度 S(SrF2)<S(BaF2),
故答案为:<;
(4)①等电子体是指原子数相同,价电子数也相同的粒子,则与CN22-互为等电子体的分子有N2O和CO2,根据CO2的电子式,仿照着可以写出CN22-的电子式: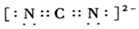 ,故答案为:CO2;
,故答案为:CO2;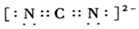 ;
;
②CaCN2与水反应生成CaCO3和NH3两种物质,反应方程式为:CaCN2+3H2O=CaCO3+2NH3,反应物为1molCaCN2与3molH2O反应,1molCaCN2中有2molσ键,3molH2O有6molσ键,因此1mol CaCN2与水反应的过程中,反应物断裂的σ键总数为8mol,即4.816×1024,
故答案为:4.816×1024;
(5)立方晶胞顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,棱上粒子占$\frac{1}{4}$,根据晶胞结构,Mg2+数目为$4×\frac{1}{2}=2$,O2-数目为$12×\frac{1}{4}=3$,根据电中性原理,Ni2+数目为1,所以该晶体的化学式为Mg2NiO3;
已知该品胞参数a pm,取1mol晶胞,则含有1molMg2NiO3,1mol晶胞的质量为m=1mol×155g/mol=155g,1mol晶胞含有NA个晶胞,一个晶胞的体积为${V}_{0}=(a×1{0}^{-10})^{3}c{m}^{3}$,因此晶体的密度为$ρ=\frac{m}{{N}_{A}×V}=\frac{155}{(a×1{0}^{-10})^{3}×{N}_{A}}g/c{m}^{3}$,
故答案为:Mg2NiO3;$\frac{155}{(a×1{0}^{-10})^{3}×{N}_{A}}$.
点评 本题主要考察物质结构知识,包含轨道表示式,共价键类型判断,电离能,晶体类型判断,溶解度,晶胞的计算.题目难度中等,是中档题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油能使溴水褪色 | |
| B. | 油脂在碱性溶液中的水解反应又称为皂化反应 | |
| C. | 油脂的氢化又称为油脂的硬化 | |
| D. | 植物油、牛油、甘油、汽油统称为油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 氧化钙 | 蒸馏 |
| B | 乙酸乙酯(乙酸) | 饱和氢氧化钠溶液 | 分液 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,此化合物类型离子化合物(填“离子化合物”或“共价化合物”).
,此化合物类型离子化合物(填“离子化合物”或“共价化合物”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2固体中所含离子数为0.4NA | |
| B. | 12g金刚石中含有的C-C键个数为1.5NA | |
| C. | 124 g P4含有的P-P键个数为6NA | |
| D. | 60 g SiO2中含Si-O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏、渗析 | B. | 分液、蒸馏、渗析、萃取 | ||
| C. | 萃取、蒸馏、分液、萃取 | D. | 蒸馏、萃取、渗析、萃取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com