
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是 ( )
① Cl2+2KI══I2+2KCl
② 2FeCl3+2HI══I2+2FeCl2+2HCl
③ 2FeCl2+Cl2══2FeCl3
④ I2+SO2+2H2O══2HI+H2SO4
A. Cl2>I2>Fe3+>SO2
B. Cl2>Fe3+>I2>SO2
C. Fe3+>Cl2>I2>SO2
D. Cl2>Fe3+>SO2>I2
科目:高中化学 来源:2017届河南省南阳、信阳等六市高三第一次联考理综化学试卷(解析版) 题型:选择题
下列有关有机物的说法中
①结构片段为……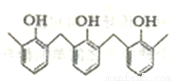 ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚
②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应: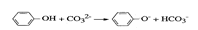
⑤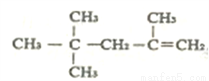 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有 个。
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源:2017届山东省临沂市高三上学期期末考试化学试卷(解析版) 题型:选择题
一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便。下列说法不正确的是 ( )
A. 对于C2H4(g)+H2O(g)=C2H5OH(g)在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数Kp=
B. 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)=2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。若此时A、B和C均增加1mol,平衡正向移动
C. 一恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)=2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动
D. 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
下列事实不能用于判断金属性强弱的是( )
A. 金属间发生的置换反应
B. 1mol金属单质在反应中失去电子的多少
C. 金属元素的最高价氧化物对应水化物的碱性强弱
D. 金属元素的单质与水(或酸)反应置换出氢气的难易程度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( )
A. 0.05 mol B. 1 mol C. 1.05 mol D. 0.13 mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
在Al2(SO4)3、K2SO4和明矾的混合液中,如果SO42-的物质的量浓度为0.2 mol·L-1,当加入等体积的0.2 mol·L-1的KOH溶液时,生成的沉淀恰好溶解,则原混合物中K+的物质的量浓度是( )
A. 0.2 mol·L-1 B. 0.25 mol·L-1
C. 0.225mol·L-1 D. 0.45 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A. K+、AlO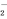 、Cl-、SO
、Cl-、SO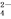
B. H+、Ba2+、Cl-、NO
C. Ca2+、Fe2+、NO 、HCO
、HCO
D. Na+、Cl-、CO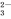 、SO
、SO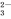
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
将3.80g碳酸钠和碳酸氢钠的固体混合物加入120mL 0.5mol•L-1的的盐酸中,充分反应后得到溶液W。下列说法一定正确的是
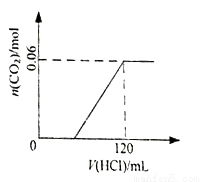
A. 溶液W中含有盐酸 B. 生成气体的物质的量与消耗盐酸体积的关系如右图
C. 将溶液W蒸发结晶所得固体质量为3.51g D. 将固体混合物充分加热后再加入120mL 0.5mol•L-1的盐酸,所得溶液组成和W相同
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
在某温度下,向三个初始体积均为1L的密闭容器中按下表所示投料,发生反应:2SO2(g)+O2(g)  2SO3(g)△H<0。达到平衡进,下列说法正确的是
2SO3(g)△H<0。达到平衡进,下列说法正确的是
容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的 物质的量/mol | ||
SO2 | O2 | SO3 | |||
Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.2 |
Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
A. 平衡时SO3的物质的量:a>1.2、b>1.2
B. 容器Ⅱ、Ⅲ中平衡常数相同
C. 容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
D. 若起始时向容器Ⅰ中充入1.0molSO2(g)、0.40molO2(g)和1.40molSO3(g),则此时V正<V逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com