
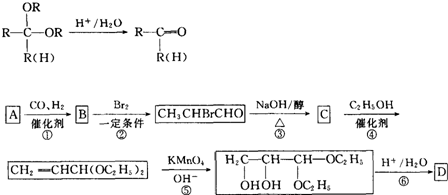
| 醇 |
| △ |
| 醇 |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
 D′→F的反应方程式为:
D′→F的反应方程式为: ,
, ;
;


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成SO3 2 mol |
| B、放出 197 kJ 的热量 |
| C、SO2 的转化率为100% |
| D、平衡时压强不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
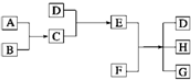 已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (盐酸)/mL(初始) | 0.00 | 0.20 | 0.10 | 0.10 |
| V (盐酸)/mL(终点) | 20.98 | 21.22 | 21.10 | 21.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com