
| A. | 用Pt电极电解少量的MgC12溶液:2H2O+2Cl- $\frac{\underline{\;通电\;}}{\;}$H2↑+C12↑+2OH- | |
| B. | H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ | |
| C. | 硫酸氢钠溶液中加入少量氢氧化钡溶液:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
分析 A、用Pt电极电解氯化镁溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气;
B、H218O中投入Na2O2固体,是过氧化氢中的+1价氧离子发生歧化反应,水中的氧离子没有参与氧化还原反应;
C、硫酸氢钠溶液中加入少量氢氧化钡溶液,硫酸氢钠过量;
D、离子方程式必须遵循电荷守恒和得失电子守恒.
解答 解:A、用Pt电极电解氯化镁溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,生成氢氧化镁沉淀,离子方程式为Mg2++2H2O+2Cl- $\frac{\underline{\;通电\;}}{\;}$ H2↑+C12↑+Mg(OH)2↓,故A错误;
B、H218O中投入Na2O2固体,是过氧化氢中的+1价氧离子发生歧化反应,水中的氧离子没有参与氧化还原反应,故B错误;
C、硫酸氢钠溶液中加入少量氢氧化钡溶液,硫酸氢钠过量,其反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B正确;
C、离子方程式Fe2++2H2O2+4H+=Fe3++4H2O,既不遵循电荷守恒也不遵循得失电子守恒,故D错误;
故选C.
点评 本题考查了离子方程式的书写,注意离子方程式遵循电荷守恒和得失电子守恒,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①和③ | B. | ②和④ | C. | ③和⑥ | D. | ④和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应混和物的浓度 | B. | 正、逆反应速率 | ||
| C. | 反应混和物的压强 | D. | 反应混合物中各物质的百分含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
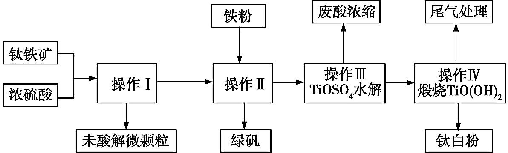
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 | |
| B. | 蒸馏时,水从冷凝管上部通入,从下部流出 | |
| C. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl- | |
| D. | 称量时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 根据分散系的稳定性,将分散系分为胶体、浊液和溶液 | |
| C. | 可吸入颗粒(如硅酸盐粉尘)能形成气溶胶,对人类的健康危害极大 | |
| D. | FeCl3溶液与Fe(OH)3胶体的本质区别是有无丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com