
| n |
| V |
| n |
| V |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
 (1)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1.
(1)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “氢能”将是未来最理想的新能源.
“氢能”将是未来最理想的新能源.查看答案和解析>>
科目:高中化学 来源: 题型:
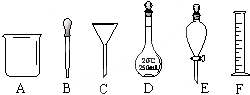 有如图A~F六种仪器:
有如图A~F六种仪器:查看答案和解析>>
科目:高中化学 来源: 题型:
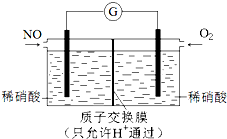 NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.| O3 |
| 反应I |
| CO(NH2)2 |
| 反应II |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、纤维素都属于天然高分子化合物,二者分子式相同,互为同分异构体 |
| B、粮食酿造的酒一定温度下密封存放时间越长香味越浓,是因为有酯生成 |
| C、鸡蛋清中加入CuSO4溶液会产生盐析现象,析出的蛋白质可再溶于水 |
| D、石油化工中的分馏、裂化、裂解都是通过化学反应来获得轻质油、气体烯烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com