
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是
A.K越大,反应物的转化率越小
B.K与反应物的浓度有关
C.K与生成物的浓度有关
D.K与温度有关
科目:高中化学 来源:2014高考名师推荐化学周期表、核素(解析版) 题型:选择题
 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关 的叙述中错误的是
的叙述中错误的是
A  的化学性质与
的化学性质与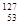 相同 B
相同 B  的原子序数为53
的原子序数为53
C  的原子核外电子数为78 D
的原子核外电子数为78 D  的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学原电池四种型与金属腐蚀、保护(解析版) 题型:选择题
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-。下列叙述错误的是

A.c电极是正极,发生还原反应
B.B口通入的是甲烷,发生氧化反应
C.放电时O2-离子向d极移动
D.d极上的电极反应式为:CH4+4O2-+8e-=CO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学用语与分类(解析版) 题型:选择题
下列有关化学用语或名称,表达错误的是
A.COCl2分子的结构式: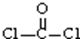
B.苯分子的比例模型: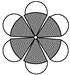
C.铁在潮湿的空气中腐蚀,负极的电极反应式:Fe-2e-===Fe2+
D.溴化铵的电子式: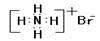
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡的标志(解析版) 题型:选择题
在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)  W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数(解析版) 题型:选择题
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数、等效平衡(解析版) 题型:填空题
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气反应为
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
A.升高温度 B.增加碳的用量C.加入催化剂 D.用CO吸收剂除去CO
(2)已知:C(s)+CO2(g)  2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)  CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为______________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为______________________________________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)  CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)_________________________
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
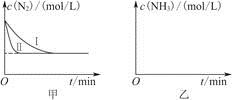
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为________________________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡图像(解析版) 题型:选择题
向某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是
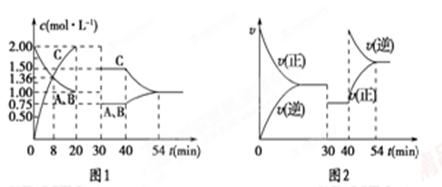
A.30 min时改变的条件是降低温度,40 min时改变的条件是升高温度
B.8 min前A的平均反应速率为0.08 mol/(L·min)
C.反应的化学方程式中的x=1,且正反应为吸热反应
D.20 min后该反应的平衡常数均为4
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学元素周期表及其应用(解析版) 题型:选择题
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如下图。下列说法正确的是
| X |
| Y |
|
|
|
| W |
|
|
|
|
|
|
A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com