
分析 (1)镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式;
(2)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(3)Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,据此判断Ni0晶胞中Ni的配位数;
(4)利用Ni的价电子数和CO提供电子对数计算得出;CO与氮气互为等电子体,故CO中C与O原子之间形成三键;
(5)根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数,根据甲醇分子甲醛分子空间构型判断其键角;
(6)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,难与Cu2+形成配位键.
解答 解:(1)镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式,Ni的核外电子排布式是[Ar]3d84s2或1s22s22p63s23p63d84s2,
故答案为:[Ar]3d84s2或1s22s22p63s23p63d84s2;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,
故答案为:>;
(3)因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni的配位数也为6,
故答案为:6;
(4)中心原子是Ni原子,其价电子数是10,每个配体提供的电子数是2,10+2n=18,n=4,CO与氮气互为等电子体,故CO中C与O原子之间形成三键,分子中σ键与π键的数目比为1:2,
故答案为:4;1:2;
(5)甲醇分子内C原子价层电子对个数=0+4=4,所以C原子的杂化方式为sp3杂化,甲醛中C原子形成3个σ键,为sp2杂化,是平面三角形结构,键角为120°,甲醇分子内碳原子形成4个σ键,无孤电子对,杂化方式为sp3杂化,是四面体结构,O-C-H键角约为109°28′,键角小于120°,所以甲醇分子内O-C-H键角比甲醛分子内O-C-H键角小,
故答案为:sp3 小于;
(6)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子,
故答案为:N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子,使得氮原子上的孤电子对难与Cu2+形成配位键.
点评 本题是对物质结构的考查,涉及核外电子排布式、熔点比较、配位数、杂化轨道、配合物等,注意掌握价层电子对理论和杂化理论,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 分子的比例模型: | B. | NH4Cl的电子式: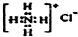 | ||
| C. | 硫离子的离子结构示意图: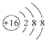 | D. | 乙烯的结构简式CH2 CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)中含有电子的数目为10NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 标准状况下,22.4L水中含有的分子数为NA | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧分子数一定为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀.溶液中一定含有SO42- | |
| B. | 加入足量的HCl溶液,有气体产生,将气体通入澄清石灰水有白色沉淀.溶液中一定含有CO32- | |
| C. | 加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体且该气体可以使湿润的红色石蕊试纸变蓝.溶液中一定含有NH4+ | |
| D. | 先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生白色沉淀.溶液中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | Cu2+、Na+、NO3-、Cl- | ||
| C. | AlO2-、K+、CO32-、SO42- | D. | NH4+、CH3COO-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na 1s22s22p53s2 | B. | S2- 1s22s22p63s23p6 | ||
| C. | N 1s22s22p3 | D. | Si 1s22s22p63s23p2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池的正极和负极必须是两种不同的金属 | |
| B. | 原电池工作时,外电路中电流的流向从原电池负极到原电池正极 | |
| C. | 原电池工作时,电解质溶液中的阴离子向负极移动 | |
| D. | 只要是放热反应就可以将其设计成原电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com