
 H、
H、 H、
H、 H中共有 种原子,它们能形成 种氢气分子。
H中共有 种原子,它们能形成 种氢气分子。 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题: Mg(OH)2+H2↑;②Al2O3+2NaOH==2NaAlO2+H2O;③Na2SiO3+CO2=Na2CO3+SiO2
Mg(OH)2+H2↑;②Al2O3+2NaOH==2NaAlO2+H2O;③Na2SiO3+CO2=Na2CO3+SiO2

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.HI和HClO | B.HCl和HIO |
| C.HClO3和HIO | D.HClO和HIO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
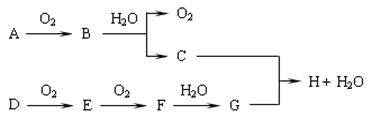
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )的说法正确的是
)的说法正确的是| A.质量数为46 | B.质子数为106 |
| C.电子数为46 | D.中子数为106 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.134 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
 与
与 的核外电子数相等
的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H2SO4>HClO4>HBrO4 | B.碱性:NaOH>KOH>RbOH |
| C.非金属性: P>S>Cl | D.气态氢化物稳定性:HF>H2O>PH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
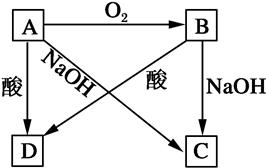
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.卤素单质随着核电荷数的增加,熔沸点逐渐升高 |
| B.酸性HF>HCl>HBr>HI |
| C.沸点HF<HCl<HBr<HI |
| D.将Cl2通入KBr溶液中,滴入四氯化碳,如果下层溶液呈橙色,说明氯的非金属性比溴强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com