


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
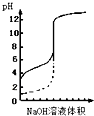
| A、△H>0的反应,常温下一定不能自发进行 | B、用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 | C、常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 | D、恒容密闭容器中进行的反应3A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | B、常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 | C、在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 | D、温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三第二次调研联考化学试卷 题型:选择题
下列说法正确的是
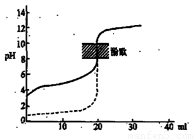
A.△H>0的反应,常温下一定不能自发进行
B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.恒容密闭容器中进行的反应3A(g) 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com