
分析 (1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)根据Fe原子的核外电子排布式确定未成对电子数,失去电子变为铁离子时,先失去4s上的电子后失去3d上的电子,硫氰化铁为血红色;
(3)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键;乙酸分子间可形成氢键导致沸点较高;
(4)根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占$\frac{1}{2}$,通过一个顶点可形成8个晶胞.
解答 解:(1)从外观无法区分三者,但用X光照射挥发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无衍射现象即可确定,
故答案为:X射线衍射;
(2)26号元素Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2,可知在3d上存在4个未成对电子,失去电子变为铁离子时,先失去4s上的2个电子后失去3d上的1个电子,因此Fe3+的电子排布式为1s22s22p63s23p63d5,硫氰化铁为血红色,
故答案为:4;1s22s22p63s23p63d5;血红色;
(3)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6molσ键,即6NA个σ键;乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛,
故答案为:sp3、sp2;6NA;乙酸存在分子间氢键;
(4)该晶胞中O原子数为4×1+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占$\frac{1}{2}$,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×$\frac{1}{2}$=12;一个晶胞中Al原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,因此Al的密度ρ=$\frac{m}{V}$=$\frac{4×27g}{{N}_{A}×(0.405×10{\;}^{-7}cm)^{3}}$=$\frac{4×27}{6.02×10{\;}^{23}×(0.405×10{\;}^{-7})^{3}}$g•cm-3,
故答案为:16;12;$\frac{4×27}{6.02×10{\;}^{23}×(0.405×10{\;}^{-7})^{3}}$.
点评 本题考查了晶体的性质、原子核外电子排布规律、共价键类型、氢键、杂化类型、晶胞配位数及密度的计算,综合性非常强,为历年高考选作常考题型,难度中等,其中晶胞配位数以及密度的计算是本题的难点.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
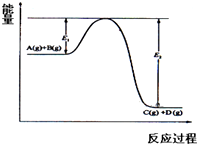 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,0.1mol铁在0.1molC12中充分燃烧,转移的电子数为0.3NA | |
| C. | 0.1mol/L的K2CO3溶液中CO32-数小于0.1NA | |
| D. | 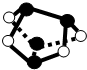 0.5mol雄黄(As4S4,结构如图)含有NA个S-S键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料属于可再生能源,不影响可持续发展 | |
| B. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| C. | 煤的气化技术在一定程度上实现了煤的高效、清洁利用 | |
| D. | 氢气燃烧热高,其燃烧产物是水,是一种理想的清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
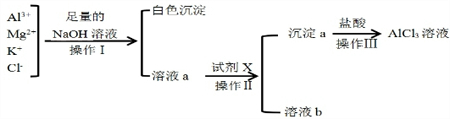 某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| D. | 反应③中1mol还原剂反应,则氧化剂得到电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成的难易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 | H2、Br2混合,加热时发生化合 | H2、I2混合,加热化合,同时又分解 |
| 氢化物的热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
| A. | 同周期元素的金属性随原子序数递增而增强 | |
| B. | 同周期元素的非金属性随原子序数递增而增强 | |
| C. | 第VIIA族元素的非金属性随电子层数的增加而减弱 | |
| D. | 第VIIA族元素的金属性随电子层数增加而减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com