
| A. | 苯(硝基苯) | B. | 乙醇(乙酸) | C. | 乙酸乙酯(乙酸) | D. | 乙酸(苯) |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L甲醇中含有的分子数为0.5NA | |
| B. | 4.4gN2O和CO2的混合气体中含有的原子数为0.3NA | |
| C. | 4.2g乙烯和丙烯混合气体中含有的共价键数为0.6NA | |
| D. | 25°C时,1.0L,PH=13 的 Ba(OH)2 溶液中含有的OH-数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
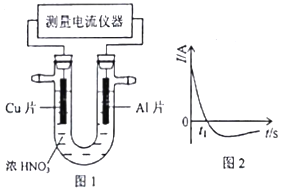 C、N、O、Na、Al、Si、S、Cl是常见的八种元素
C、N、O、Na、Al、Si、S、Cl是常见的八种元素 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
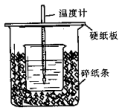 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-1-丁烯催化加氢后得到3,3-二甲基-丁烷 | |
| B. | 2-甲基-1,3-丁二烯与Br2的加成产物有3种 | |
| C. | 根据所有原子不在同一平面上可以说明C4H6的某烃是1-丁炔而不是CH2=CH-CH=CH2 | |
| D. | 已知具有单双键交替长链(如:-CH=CH-CH=CH-CH=CH-)的高分子有可能成为导电塑料,故聚乙烯和聚乙炔均可成为导电塑料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子比例模型: | |
| B. | 原子核内有18个中子的原子:${\;}_{17}^{35}$Cl | |
| C. | 1,2-二溴乙烷的结构简式:C2H4Br2 | |
| D. | 过氧化氢电子式: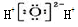 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
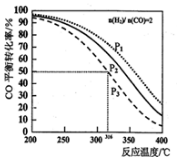
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com