
| A. | △H>0表示放热反应,△H>0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热量叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
分析 A.放热反应的焓变小于0,吸热反应的焓变大于0;
B.热化学方程式中的化学计量数只表示物质的量,不表示分子数;
C.在稀溶液转化强酸与强碱反应生成1mol水放出的热量为中和热;
D.根据燃烧热的定义判断.
解答 解:A.反应物的总焓大于生成物的总焓,则焓变小于0,为放热反应,所以,△H<0表示放热反应,△H>0表示吸热反应,故A错误;
B.热化学方程式中的化学计量数只表示物质的量,不表示分子数,所以可用分数或小数表示,故B正确;
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时,水的物质的量为2mol,不是中和热,故C错误;
D.1mol可燃物燃烧生成稳定氧化物放出的热量是燃烧热,没有说明水的状态,故D错误;
故选B.
点评 本题考查了热化学方程式的含义、燃烧热和中和热的概念,题目难度不大,侧重于基础知识的考查,把握燃烧热和中和热的概念是解题的关键.


科目:高中化学 来源: 题型:解答题
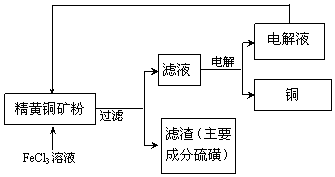
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 品名 | 蔬菜苏打饼 |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2016 年8月20日 |
| A. | 富含蛋白质的是鸡蛋 | |
| B. | 富含维生素的是脱水青菜和橙汁 | |
| C. | 富含糖类的物质只有白砂糖 | |
| D. | 富含油脂的是精炼食用植物油和奶油 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4 固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入溴水中,观察溴水是否褪色 | |
| B. | 通入酸性高锰酸钾溶液中,观察颜色变化 | |
| C. | 点燃,检验燃烧产物 | |
| D. | 点燃,观察火焰明亮程度及产生黑烟量的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.
乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
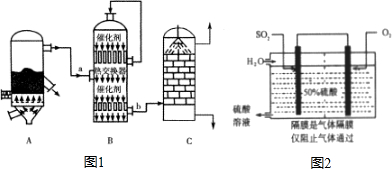 硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com