
【题目】反应:L(s)+aG(g)![]() bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
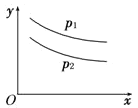
A. 上述反应是放热反应B. 上述反应是吸热反应
C. a+1>bD. a+1<b
【答案】B
【解析】
A、根据图知,压强不变时,升高温度,G的体积分数减小,说明平衡正向移动,升高温度平衡向吸热方向移动,所以正反应是吸热反应,故A错误;
B、根据图知,压强不变时,升高温度,G的体积分数减小,说明平衡正向移动,升高温度平衡向吸热方向移动,所以正反应是吸热反应,故B正确;
C、由题意可知:温度一定时, p1>p2即增大压强,G的体积分数增大,平衡逆向移动,增大压强平衡向气体体积减小的方向移动,所以a<b,因为L为固体,固体质量的多少不影响平衡移动,故C错误;
D、由题意可知:温度一定时,增大压强,G的体积分数增大,平衡逆向移动,增大压强平衡向气体体积减小的方向移动,所以a<b,故D错误;
所以B选项是正确的。


科目:高中化学 来源: 题型:
【题目】在一定温度下,将2mol A和2mol B两种气体相混合于体积为2L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)X的值等于__________;
(2)A的转化率为_________________。
(3)生成D的反应速率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(Cu2S,含有SiO2和少量Fe2O3等杂质)为原料制备碱式碳酸铜的流程如图所示:

已知:①有关金属离子形成氢氧化物沉淀的pH范围如下:

②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有___(任写一种)。
(2)滤渣I经CS2提取后可获得一种淡黄色副产品,则滤渣I中的主要成分是___(填化学式)。回收淡黄色副产品过程中温度控制在50~60℃之间,不宜过高或过低的原因是___。
(3)常温下“除铁”时加入的试剂A可用CuO,调节pH的范围为___,若加A后将溶液的pH调为5,则溶液中Fe3+的浓度为___ mol/L。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:___。
(5)“赶氨”时,最适宜的操作方法是___。
(6)测定副产品MnSO4·H2O样品的纯度:准确称取样品14.00g,加蒸馏水配成100mL溶液,取出25.00mL用标准的BaCl2溶液测定,完全反应后得到了4.66g沉淀,则此样品的纯度为___(保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作、现象所得出的结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 向氯水中滴加硝酸酸化的AgNO3溶液 | 产生白色沉淀 | 氯水中含有Cl﹣ |
B | 向某溶液中滴加盐酸 | 有无色气体产生 | 溶液中一定有CO32﹣ |
C | 向某溶液中加入烧碱溶液后加热,用湿润的红色石蕊试纸检验 | 石蕊试纸变蓝 | 溶液中有NH4+ |
D | 将SO2通入到酸性KMnO4溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”已成为各地的标牌。
(1)硫酸工业排出的尾气(主要含SO2)有多种处理方式
①下列物质中可以吸收硫酸工业尾气的是___
a.饱和Na2SO3溶液 b.饱和NaCl溶液 c.稀H2SO4 d.浓氨水
②硫酸工业排出的尾气也可用软锰矿浆(主要成分为MnO2)吸收,生成MnSO4,写出反应的化学方程式___。
(2)治理汽车尾气中NO和CO的方法之一是在汽车的排气管上装一个催化转化装置,使NO和CO在催化剂作用下转化为无毒物质。写出该反应的化学方程式:___。
(3)用NaOH溶液亦可以吸收废气中的氮氧化物,化学方程式如下NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O
①上述两反应中分别消耗等量的NO2时,转移电子的物质的量之比为___。
②标准状况下5.6L混合气体(只有NO、NO2)被0.5molL﹣1NaOH溶液完全吸收,至少需要NaOH溶液的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动
C. 平衡向逆反应方向移动
D. 物质C的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取Ni(CO)4。
已知:CO+PdCl2+H2O=CO2+Pd↓(黑色)+2HCl;Ni(CO)4熔点-25℃,沸点43℃,60℃以上与空气混合易爆炸;Fe(CO)5熔点-20℃,沸点103℃。

回答下列问题:
(1)装置A中发生反应的化学方程式为__。
(2)装置C用于合成Ni(CO)4夹持装置略,最适宜选用的装置为__(填标号)。

(3)实验过程中为了防止__,必须先观察__。
(4)制得的Ni(CO)4中常溶有Fe(CO)5等杂质,提纯的方法是__(填标号)。
A.分液 B.蒸馏 C.过滤 D.重结晶
(5)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中充有CO气体,则高纯镍粉在封管的__温度区域端生成(填“323K”或“473K”)。

(6)实验中加入11.50gHCOOH,C装置质量减轻2.95g设杂质不参加反应 ,E装置中盛有PdCl2溶液100mL,则PdCl2溶液的物质的量浓度至少为__molL-1(填实验现象再加热C装置)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com