
| A. | 冰 | B. | 过氧化钠 | C. | 氯化钠 | D. | 白磷 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率理论可指导怎样在一定时间内快出产品 | |
| B. | 化学平衡理论可指导怎样使用有限原料多出产品 | |
| C. | 当反应达到限度时,无论外界条件如何变化,反应体系内各物质含量始终不变 | |
| D. | 正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
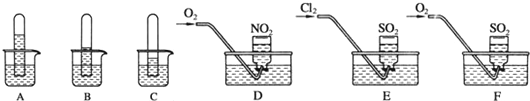
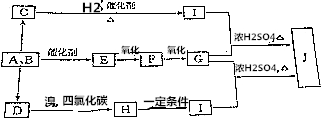
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
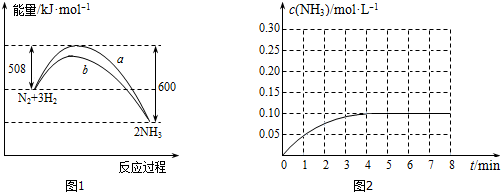
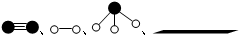 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).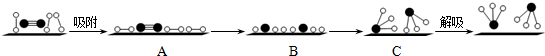
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m:n:w=3:1:2 | |
| B. | 体积和温度不变时,若在前10s内A减少了x mol,则B在前20s内减少$\frac{2x}{3}$ mol | |
| C. | 体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| D. | 单位时间内反应物浓度的减少大于生成物浓度的增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
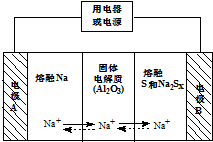 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com