
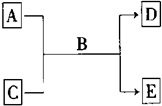
 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:

科目:高中化学 来源: 题型:
| A、尿素是人类第一次合成的蛋白质 |
| B、光导纤维和合成纤维都属于有机高分子材料 |
| C、苯、汽油、无水乙醇都是纯净物 |
| D、煤经气化和液化两个化学变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 温度(℃) | 300 | 400 | 500 |
| K② | 3.1×1015 | 1.66×1014 | 5.3×1013 |
| K③ | 4.0×1020 | 3.6×1018 | 5.7×1017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
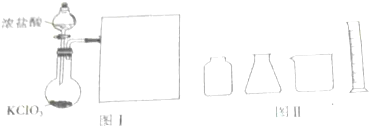
查看答案和解析>>
科目:高中化学 来源: 题型:
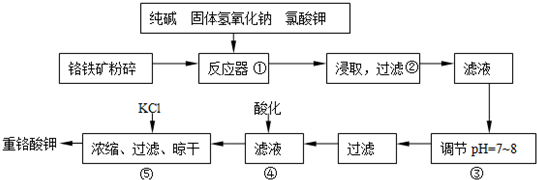
 已知亚铝酸钠(NaClO2)为白色粉末,易溶于水,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2
已知亚铝酸钠(NaClO2)为白色粉末,易溶于水,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2查看答案和解析>>
科目:高中化学 来源: 题型:
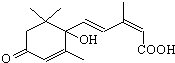 国庆期间对天安门广场大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对天安门广场大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A、其分子式为C15H18O4 |
| B、1mol该物质与NaOH溶液反应,最多可消耗2mol NaOH |
| C、既能发生加成反应,又能发生取代反应和消去反应 |
| D、既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
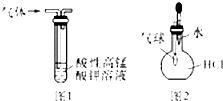
| A、用干燥pH试纸测定某新制氯水的pH |
| B、用25mL碱式滴定管量取20.00mL KMnO4溶液 |
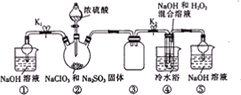
| C、用图1装置除去乙烷中混有的乙烯 |
| D、用图2装置能验证HCl气体在水中的溶解性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com