
| 物质 | MgCO3 | Li2CO3 | Mg(OH)2 |
| Ksp | 6.82×10-6 | 8.2×10-4 | 5.6×10-12 |
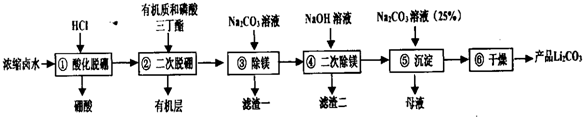
分析 浓缩卤水加入盐酸使大部分的B元素转化为硼酸(H3BO3)沉淀,再利用有机物和和磷酸三丁酯进行二次脱硼,萃取含有的B元素,通过分液分离出有机层,水层中加入碳酸钠进行除镁,滤渣一为碳酸镁,过滤后加入氢氧化钠溶液进行二次除镁,滤渣二为氢氧化镁,过滤后的滤液中加入碳酸钠溶液得到Li2CO3沉淀,过滤分离,母液中含有氯化钠等.
(1)过程①是Na2B4O7与盐酸反应生成H3BO3沉淀;
(2)②是利用机物和和磷酸三丁酯萃取含有的B元素,再通过分液分离;磷酸三丁酯在浓氢氧化钠溶液中会发生酯的水解反应;
(3)根据Li2CO3的溶度积计算c(CO32-),再结合MgCO3的溶度积计算c(Mg2+);
(4)滤渣一为碳酸镁,滤渣二为氢氧化镁;
(5)向上层清液中继续加入碳酸钠溶液,若无沉淀出现,说明沉淀完全;
(6)将Li2CO3与CoCO3按1:1的比例混合,再在空气中灼烧可得LiCoO2,Co元素化合物升高,发生氧化反应,有氧气参加反应,反应还生成二氧化碳;
一种钻酸锂电池的工作原理如下:LixC6+Li1-xCoO2=LiCoO2+C6,该电池在充电时负极上发生还原反应,C6获得电子生成LixC6.
解答 解:浓缩卤水加入盐酸使大部分的B元素转化为硼酸(H3BO3)沉淀,再利用有机物和和磷酸三丁酯进行二次脱硼,萃取含有的B元素,通过分液分离出有机层,水层中加入碳酸钠进行除镁,滤渣一为碳酸镁,过滤后加入氢氧化钠溶液进行二次除镁,滤渣二为氢氧化镁,过滤后的滤液中加入碳酸钠溶液得到Li2CO3沉淀,过滤分离,母液中含有氯化钠等.
(1)过程①是Na2B4O7与盐酸反应生成H3BO3沉淀,离子方程式为:B4O72-+2H++5H2O=4H3BO3↓,
故答案为:B4O72-+2H++5H2O=4H3BO3↓;
(2)②是利用机物和和磷酸三丁酯萃取含有的B元素,再通过分液分离,②过程中的操作名称是:萃取反应,磷酸三丁酯在浓氢氧化钠溶液中会发生酯的水解反应,
故答案为:萃取分液;避免氢氧化钠溶液浓度过大使磷酸三丁酯水解;
(3)溶液中c(Li+)=5mol/L,则此时溶液中c(CO32-)=$\frac{Ksp(L{i}_{2}C{O}_{3})}{{c}^{2}(L{i}^{+})}$=$\frac{8.2×1{0}^{-4}}{{5}^{2}}$mol/L=3.28×10-5mol/L,结合MgCO3的溶度积,可知溶液c(Mg2+)=$\frac{6.82×1{0}^{-6}}{3.28×1{0}^{-5}}$mol/L=0.21mol/L,
故答案为:0.21mol/L;
(4)滤渣一,滤渣二的主要成分分别是 MgCO3、Mg(OH)2,
故答案为:MgCO3、Mg(OH)2;
(5)检验第⑤步中Li+是否沉淀完全方法:取少量上层清液于试管中,继续加入碳酸钠溶液若无沉淀出现,则沉淀完全,
故答案为:取少量上层清液于试管中,继续加入碳酸钠溶液若无沉淀出现,则沉淀完全;
(6)将Li2CO3与CoCO3按1:1的比例混合,再在空气中灼烧可得LiCoO2,Co元素化合物升高,发生氧化反应,有氧气参加反应,反应还生成二氧化碳,反应方程式为:2Li2CO3+4CoCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$4LiCoO2+6CO2,
一种钻酸锂电池的工作原理如下:LixC6+Li1-xCoO2=LiCoO2+C6,该电池在充电时负极上发生还原反应,C6获得电子生成LixC6,电极反应式为:xLi++xe-+C6=LixC6,
故答案为:2Li2CO3+4CoCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$4LiCoO2+6CO2;xLi++xe-+C6=LixC6.
点评 本题是物质制备工艺流程题目,涉及物质分离提纯实验操作、对操作与原理的分析评价、溶度积有关计算、陌生方程式书写、电化学原理与电极反应式书写等,是对学生综合能力的考查,关键是对工艺流程的理解.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
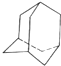 油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| B. | 锌片插入稀H2SO4溶液中:Zn+2H+═Zn2++H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
| t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
| t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6 L H2,该乙醇分子中共价键总数为4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的熔点一般比组分金属高 | B. | 合金中只含金属元素 | ||
| C. | 合金的机械性能一般比组分金属好 | D. | 合金的硬度一般比组分小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧 | B. | NaOH溶液滴入NH4HCO3溶液 | ||
| C. | 稀硝酸中加入铁粉 | D. | 镁与H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com