
【题目】下列离子既能电离又能水解,且能与强碱溶液反应的是( )
A.CH3COO﹣
B.HSO4﹣
C.HSO3﹣
D.CO32﹣
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为原料生产重铬酸钠Na2Cr2O7·2H2O,其流程如下:
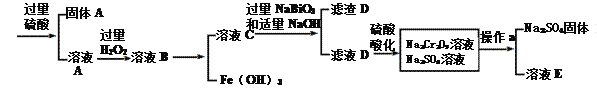
查阅资料得知:
①常温下,NaBiO3难溶于水,有强氧化性。
②常温下,Ksp[Cr(OH)3]=6.4×10-31 Ksp[Fe(OH)3]=4.0×10-38 lg2.5=0.4
③物质溶解度曲线如图所示。
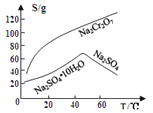
回答下列问题:
(1)Na2Cr2O7·2H2O铬的价态是____,H2O2的电子式为__________。
(2)NaBiO3的作用__________。
(3)滤渣D的成分是__________。
(4)操作a的名称是________、__________。
(5)电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。处理该废水的流程为:

①流程中,Na2S2O3参与反应的的离子方程式__________。
②a=_______,Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1];若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为_______。
【答案】 +6 ![]() 作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
【解析】(1)Na2Cr2O7·2H2O中钠的化合价为+1价,氧的化合价为-2价,氢的化合价为+1价,根据化合物中各元素化合价代数和为0可推出铬的价态为+6价,H2O2的电子式为![]() ;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=
;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=![]() =6.4×10-26,c(OH-)=4.0×10-9,c(H+)=
=6.4×10-26,c(OH-)=4.0×10-9,c(H+)=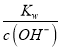 =
=![]() =2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
=2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
【题型】综合题
【结束】
11
【题目】【化学—选修3:物质结构与性质】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅(2814Si)原子中,电子占据的最高能层的轨道数有______个。
(2)已知:蓝色晶体(CuSO4·5H2O)![]() 天蓝色溶液
天蓝色溶液![]() 深蓝色溶液
深蓝色溶液![]() 深蓝色晶体
深蓝色晶体
①蓝色晶体中阴离子的空间构型是_________;
②天蓝色溶液中的阳离子是_____,其配体中心原子的杂化轨道类型是________;
③24.6g深蓝色晶体(其摩尔质量为246g.mol-1)中配离子含有的σ键数是_____;
④实验测得无水乙醇易溶于水,其原因是______________。
(3)砷化镓是具有空间网状结构的晶体,熔点为1230℃,是优良的第三代半导体材料。
①砷化镓属于________晶体。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_____(填化学式),其理由是_________。上述两种晶体中的四种元素电负性最小的是_______(填元素符号)。
②砷化镓晶胞结构如图所示。其晶胞边长为a pm,密度为_______g.cm-3。(砷化镓的摩尔质量为M g.mol-1,阿伏伽德罗常数为NA)
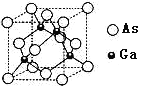
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X是一种黄绿色气体,X、Y、Z都是有刺激性气味的气体,M是一种金属单质,D是一种盐,受热易分解。有以下转化关系,部分产物未标出。
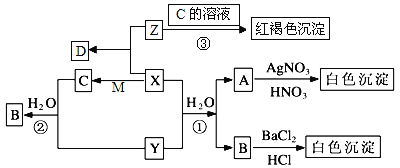
试回答:
(1)写出下列物质的化学式:X________、Y________、M________、D________。
(2)写出下列反应的离子方程式
①_______________________________________,
②_______________________________________,
③_______________________________________。
(3)Z是合成硝酸的重要原料,请写出其与氧气在催化剂的作用下反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某元素在化学反应中由化合态变为游离态,则该元素可能被还原
B.金属原子失电子越多,还原性越强
C.强电解质溶液的导电能力一定比弱电解质强
D.NaHSO4在水溶液中电离时生成的阳离子有氢离子,所以是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验(A为电流计):

观察到现象:
装置图1:Cu电极上产生大量的无色气泡
装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡
则下列说法正确的是
A. 图1是电解池,图2是原电池
B. 两个电池中,电子均由Cr电极流向Cu电极
C. 图2中Cr电极可能被浓HNO3钝化成惰性电极
D. 由实验现象可知金属活动性:Cu>Cr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化: 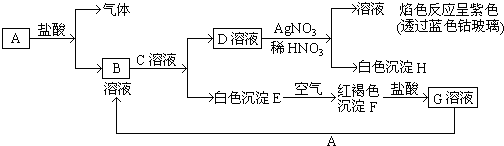
试回答:
(1)写出B的化学式D的化学式 .
(2)写出由E转变成F的化学方程式 .
(3)写出用KSCN鉴别G溶液的离子方程式;向G溶液加入A的有关离子反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强. 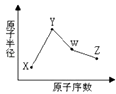
(1)W位于元素周期表中第周期第族.画出X的阴离子的结构示意图 .
(2)Z的氢化物和溴化氢相比,较稳定的是(写化学式);Z的氢化物与氟化氢相比,沸点较高的是(写化学式).
(3)Y的金属性与Mg的金属性相比,(写化学式)的金属性强,请用实验证明它们金属性的相对强弱: .
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾因可能致癌而陷舆论风波的除草剂一一草甘膦已于2017 年11月被相关部门正式批准可继续使用,其结构如图所示,下列说法不正确的是

A. 1mol 的草甘膦可以与3mol 的NaOH中和
B. 分子式为C3H8NO5P
C. 可以溶于水
D. 属于酯类的同分异构体只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是中学常见的四种元素,原子序数依次增大。X的原子最外层电子数是次外层的2倍,Y 的氧化物属于两性氧化物,Y、Z 位于同周期,X、Y、Z的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)X在元素周期表中的位置是_________________。
(2)下列事实能用元素周期律解释的是_____________________________________(填字母序号)。
A.Y 的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.Z的气态氢化物的稳定性小于HF
C.WZ3的溶液可用于刻蚀铜制的印刷电路板
(3)Z的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因是______________________。
(4)工业上用电解法制备Y单质,化学方程式为___________________________。
(5)家用“管道通”的有效成分是烧碱和Y 的单质,使用时需加入一定量的水,此时发生反应的化学方程式为______________________________。
(6)W的单质可用于处理酸性废水中的NO3-,使其转化成为铵根离子,同时生成磁性的W的氧化物H,再进行后续处理。相应离子方程式为____________。Y 的单质与H在高温下反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com