
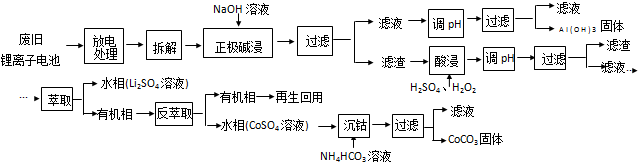
分析 废旧锂离子电池放电处理拆解后正极用氢氧化钠溶液碱溶过滤得到滤液调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入硫酸,过氧化氢调节溶液PH过滤得到滤液加入萃取剂萃取分液得到水层为硫酸锂,有机层通过反萃取得到水层硫酸钴溶液加入碳酸氢铵溶液沉淀钴离子得到碳酸钴固体;
(1)根据化合物中,化合价的代数和为0判断;
(2)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀.
解答 解:(1)根据化合物中,化合价的代数和为0知,LiCoO2中,Co元素的化合价为+3价,故答案为:+3;
(2)正极中含有铝,铝易溶于强碱溶液生成AlO2-,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4$\frac{\underline{\;80℃\;}}{\;}$Li2SO4+2CoSO4+O2↑+4H2O,由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,且引入氯离子杂质,在后续步骤中难以分离,
故答案为:2LiCoO2+H2O2+3H2SO4$\frac{\underline{\;80℃\;}}{\;}$Li2SO4+2CoSO4+O2↑+4H2O;有氯气生成,污染较大,引入氯离子杂质,在后续步骤中难以分离;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀、硫酸铵、二氧化碳和水,反应方程式为CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O.
点评 本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:推断题
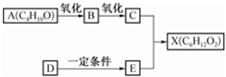 如图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精.已知D在标准状况下的密度为1.25g•L-1,其产量可以用来衡量一个国家石油化工发展水平.E是生活中常见的一种有机物.各物质间转化关系如图:
如图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精.已知D在标准状况下的密度为1.25g•L-1,其产量可以用来衡量一个国家石油化工发展水平.E是生活中常见的一种有机物.各物质间转化关系如图: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温同浓度Na2CO3和Na2SiO3水溶液的pH前者小于后者,则碳的非金属性强于硅 | |
| B. | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后加新制Cu(OH)2悬浊液,加热,无砖红色沉淀,则淀粉没有水解成葡萄糖 | |
| C. | 向无色溶液中加入氯水,再加CCl4,振荡静置后CCl4层呈紫色,则原溶液中含I- | |
| D. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液中一定含有CO32-或HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
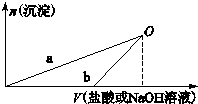 某同学研究铝及其化合物的性质时设计了如下两个实验方案:
某同学研究铝及其化合物的性质时设计了如下两个实验方案:| A. | b曲线表示的是向X溶液中加入NaOH溶液 | |
| B. | 在O点时两方案中所得溶液浓度相等 | |
| C. | a、b曲线表示的反应都是非氧化还原反应 | |
| D. | X溶液显酸性,Y溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO | B. | 石脑油(C5H12,C6H14) | ||
| C. | CH4 | D. | 焦炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )
如图所示,集气瓶内充满某混合气体:①CO、CH4 ②Cl2、CH4 ③NO2、O2 ④N2、H2,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶.集气瓶的气体是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com