
| A. | 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{1}{2}$ | |
| B. | 向酒精灯里添加酒精,不可超过酒精灯容积的$\frac{2}{3}$ | |
| C. | 酒精灯使用完毕,应立即用嘴吹灭火焰 | |
| D. | 用燃着的酒精灯去点燃另一盏酒精灯 |
分析 给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{1}{3}$;向酒精灯中加酒精时,不能超过酒精灯溶积的$\frac{2}{3}$,酒精灯使用完毕,应使用灯帽盖灭,不能用燃着的酒精灯去点燃另一盏酒精灯,据此分析.
解答 解:A、给试管里的液体加热,液体的体积一般不超过试管容积的$\frac{1}{3}$,否则容易导致溶液溅出伤人,故A错误;
B、向酒精灯中加酒精时,不能超过酒精灯溶积的$\frac{2}{3}$,否则容易引起酒精灯的爆炸并引发火灾,故B正确;
C、酒精灯使用完毕,应使用灯帽盖灭,不能用嘴吹灭,故C错误;
D、用燃着的酒精灯去点燃另一盏酒精灯容易导致酒精洒出,引发火灾,故D错误.
故选B.
点评 本题考查了实验安全问题,规范基本的实验操作是保证实验安全的前提,难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
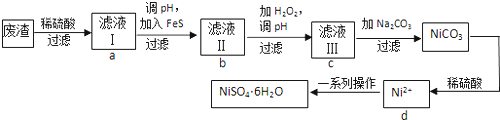
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都是高分子化合物 | |
| B. | 乙醇和乙酸都能与金属钠反应生成氢气 | |
| C. | 淀粉(C6H10O5)n和纤维素(C6H10O5)n互为同分异构体 | |
| D. | 石油的分馏和煤的干馏均只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
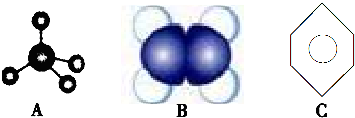
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
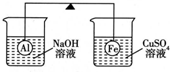 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )| A. | 铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡 | |
| B. | 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉 | |
| C. | 反应后去掉两烧杯,杠杆仍平衡 | |
| D. | 右边球上出现红色,左边溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
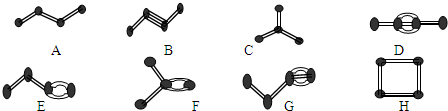
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠具有醛基性质 |
| B | 加溴水,振荡,过滤除去沉淀 | 除去苯中混有的苯酚 |
| C | 给碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液 | 验证酸性: 盐酸>碳酸>苯酚 |
| D | 氯乙烷和氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液 | 验证产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
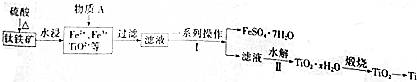
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com