
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
| c(CO)/×10-4mol?L-1 | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
| 实验编号 | T/℃ | NO初始浓度mpl?L-1 | CO初始浓度mpl?L-1 | 催化剂的比表面积m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | a | 1.20×10-3 | c | 124 |
| Ⅲ | 350 | b | 5.80×10-3 | 124 |
| 1.25×10-4mol/L |
| 2s |
| 1 |
| 2 |
| (2×10-4)2?(1×10-4) |
| (1×10-4)2?(2×10-4)2 |


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
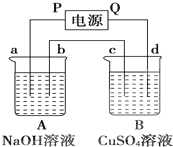 按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答:
按如图装置实验,A、B两烧杯分别盛放200g10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出.又测得烧杯A溶液的质量减少4.5g,电极均为石墨电极,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关 |
| B、盖斯定律遵守能量守恒定律 |
| C、利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D、利用盖斯定律可以计算有副反应发生的反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滤液中c(Fe3+)=4.0×10-29mol?L-1 |
| B、沉淀为Fe(OH)3和Fe(OH)2的混合物 |
| C、向滤液中加入少量FeCl2溶液,一定有沉淀生成 |
| D、向滤液中继续加入NaOH溶液使pH>7时,有Fe(OH)2沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com