
| ||
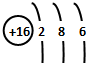 ;地壳中含量最多的非金属元素为O;O与S形成二氧化硫和三氧化硫,S与O之间形成共价键;
;地壳中含量最多的非金属元素为O;O与S形成二氧化硫和三氧化硫,S与O之间形成共价键;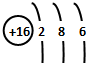 ;O;共价键;
;O;共价键;
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、气体的密度不再增大 |
| B、混合气体中A的体积分数不再变化 |
| C、混合气体的总压不再变化 |
| D、单位时间内生成a mol A,同时生成3a mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:
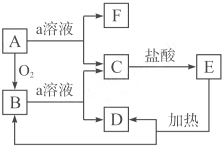 如图,A是一种非金属单质,E是一种白色沉淀.据图填空:
如图,A是一种非金属单质,E是一种白色沉淀.据图填空:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
|
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组对H2O2的分解做了如下探究:
某实验小组对H2O2的分解做了如下探究:| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂 不加热 |
几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂 加热 |
360 | 480 | t | 720 |
| MnO2催化剂 加热 |
10 | 25 | 60 | 120 |
| 催化剂 MnO2 |
操作 情况 |
观察结果 | 反应完成 所需时间 |
| 粉末状 | 混合 不振荡 |
剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- |
| B、向Na2SiO3溶液中逐滴加入稀盐酸:2H++SiO32-═H2SiO3(胶体) |
| C、向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ |
| D、将铜片投入浓硝酸中:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com