
| A. | 转移容易后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称氢氧化钠固体时直接放在称量纸上称 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
分析 分析操作对溶质的物质的量n和溶液体积V的影响,依据C=$\frac{n}{V}$,凡是使n偏大或者使V偏小的操作,都能使浓度偏高,反正,溶液浓度偏低,据此解答.
解答 解:A.转移容易后未洗涤烧杯和玻璃棒就直接定容,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.氢氧化钠具有吸水性,称氢氧化钠固体时直接放在称量纸上称,导致称取溶质氢氧化钠质量偏小,溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.在容量瓶中进行定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故C选;
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:C.
点评 本题考查一定物质的量浓度的溶液的配制误差分析,题目难度不大,明确配制原理依据C=$\frac{n}{V}$即可解答,注意仰视、俯视对体积读数的影响.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
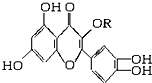 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1 mol该物质可与5 mol NaOH发生反应 | |
| B. | 1 mol该物质与足量浓溴水反应,最多消耗6 mol Br2 | |
| C. | 一定条件下1 mol该物质可与H2加成,消耗H2最大量为6 mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
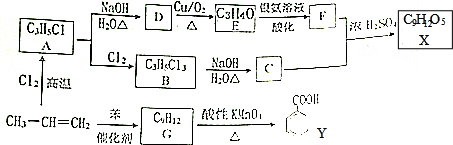
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
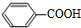 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$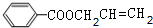 +H2O.
+H2O.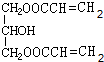 (任写一种即可).对于化合物X,下列说法正确的是AC.
(任写一种即可).对于化合物X,下列说法正确的是AC.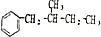 :则Z的同分异构体中,符合
:则Z的同分异构体中,符合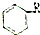 结构且有2个CH3的有3种(不包括Z).
结构且有2个CH3的有3种(不包括Z).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数K=$\frac{8}{3}$ | |
| B. | 达到平衡后NO2和SO2的转化率相等 | |
| C. | SO3和NO的体积比保持不变可以证明达到平衡状态 | |
| D. | 每消耗1molSO3的同时生成1molNO2可以证明达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2}{5}$ mol | B. | $\frac{11}{5}$ mol | C. | $\frac{1}{5}$ mol | D. | $\frac{1}{3}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
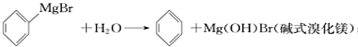
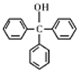 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.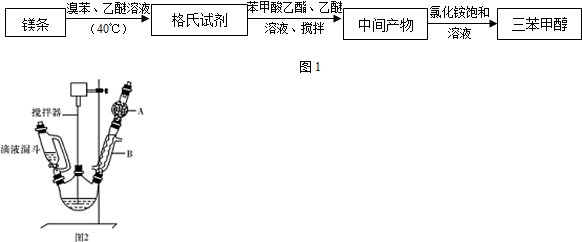
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极100g,阴极128g | B. | 阳极96.8g,阴极110.8g | ||
| C. | 阳极94.8g,阴极108.8g | D. | 阳极95.9g,阴极114.0g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com