

分析 制取NaClO2晶体:装置②中发生反应:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,可能发生Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2 被带入④中,SO2与H2O2 反应生成硫酸钠,生成的ClO2气体经装置③进入装置④,发生反应:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,得NaClO2溶液,经蒸发结晶、过滤、洗涤、干燥等操作,得晶体NaClO2•3H2O,要注意根据题目所给信息,控制温度,装置①⑤是吸收多余气体防止污染.
(1)装置④中气体反应,装置内压强降低,装置③防止倒吸;
(2)亚硫酸钠具有还原性,在装置②中的反应中作还原剂;装置④反应后的溶液获得NaClO2晶体,装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,据此书写方程式;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)反应结束时,碘反应完全,滴加最后一滴液体时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)根据关系式NaClO2~2I2~4S2O32-进行计算;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘所致.
解答 解:(1)装置②中发生反应:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,可能发生Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2 被带入④中,SO2与H2O2 反应生成硫酸钠,生成的ClO2气体经装置③进入装置④,发生反应:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,装置④中气体反应,装置内压强降低,装置③为安全瓶,防止产生倒吸,
故答案为:防止倒吸;
(2)亚硫酸钠具有还原性,在反应中作还原剂;装置②中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:用38-60℃的温水洗涤;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且30 s内不变色,说明到达滴定终点,
故答案为:溶液由蓝色变为无色,且30 s内不变色;
(5)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
mag c mol•L-1×V×10-3L×$\frac{250ml}{25ml}$,
所以90.5g:mag=4mol:c mol•L-1×V×10-3L×$\frac{250ml}{25ml}$,
解得a=$\frac{90.5cV}{4m}$%,
故答案为:$\frac{90.5cV}{4m}$%;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘,同时生成水,反应离子方程式为4I-+O2+4H+=2I2+2H2O,
故答案为:4I-+O2+4H+=I2+2H2O.
点评 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应滴定等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,题目难度中等,注意氧化还原反应滴定中利用关系式进行的计算.


科目:高中化学 来源: 题型:选择题
| A. | 中和反应的反应热测定需用温度计测量温度二次,分别为反应的起始温度和最高温度 | |
| B. | 用试纸检验气体时,可先把试纸用蒸馏水润湿,粘在玻璃棒一端,用玻璃棒把试纸放到盛待测气体的容器口附近 | |
| C. | 用剩的药品能否放回原瓶,应视具体情况而定 | |
| D. | 将铂丝放在盐酸中洗涤并灼烧为无色后,再蘸取待测物进行焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
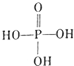
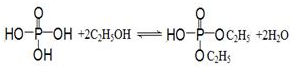 .
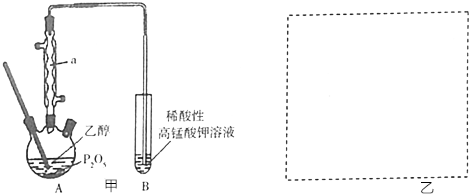
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:
亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com