
分析 ①依据化合物中各种元素化合价代数和为0计算解答;
②水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石即碳酸钙,据此分析解答;聚乙烯为线型结构;
③在电化学腐蚀中,负极是金属发生失电子的氧化反应;
④SiCl4与O2在高温条件下通过置换反应制得SiO2,根据置换反应的概念来分析反应产物.
解答 解:①铝、硅、氧、氢氧根分别显+3价、+4价、-2价、-1价,依据化合物中各元素的化合价代数和为0,则有(+3)×2+(+4)×2+(-2)×x+(-1)×4=0,即x=5,
故答案为:5;
②生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥.所以在玻璃工业、水泥工业中都用到的原料是石灰石即碳酸钙;聚乙烯为线型结构,故为热塑性塑料,
故答案为:碳酸钙;热塑性;
③金属的电化学腐蚀分为吸氧腐蚀和析氢腐蚀,以吸氧腐蚀更为普遍,在两种电化学腐蚀中,负极都是金属铁发生失电子的氧化反应,即Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
④SiCl4与O2在高温条件下通过置换反应制得SiO2,由于置换反应的概念是一种单质和一种化合物反应生成另一种单质和另一种化合物,故SiCl4与O2在高温条件下除了生成SiO2还生成氯气,故化学方程式为:SiCl4+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+2Cl2,故答案为:SiCl4+O2$\frac{\underline{\;高温\;}}{\;}$SiO2+2Cl2.
点评 本题考查了硅酸盐工业的原料、化学方程式的书写和电化学腐蚀,应注意的是无论是钢铁的吸氧腐蚀还是析氢腐蚀,负极都是金属铁发生失电子的氧化反应.


科目:高中化学 来源: 题型:解答题
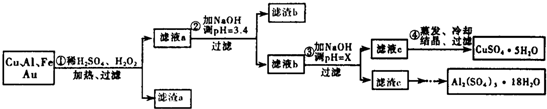
| 沉淀物 | Fe(OH)3 | Al(OH3) | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液与铜反应:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 硅酸钠与稀硫酸反应:Na2SiO3+2H+═2Na++H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
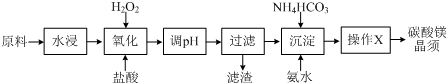
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.9 | 11.1 |
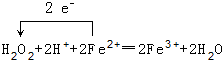 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
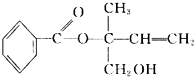
| A. | 有机物M和油脂都含有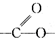 ,两者在酸性或碱性条件下都能发生取代反应 ,两者在酸性或碱性条件下都能发生取代反应 | |
| B. | M在一定条件下能发生加聚反应,不能发生酯化反应 | |
| C. | 在Ni作催化剂的条件下,1 mol M最多只能与1molH2加成 | |
| D. | 不可用酸性高锰酸钾溶液区分苯和M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用有机溶剂从青蒿中提取青蒿素,主要采用萃取的方法 | |
| B. | 青蒿素的分子式为C15H22O5 | |
| C. | 青蒿素通过还原反应可制得双氢青蒿素 | |
| D. | 青蒿素和双氢青蒿素都是芳香族化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com