
| A. | 1 mol H2的质量只有在标准状况下才约为2 g | |
| B. | 在标准状况下,某气体的体积是22.4 L,则可认为该气体的物质的量约是1 mol | |
| C. | 在20℃时,1 mol任何气体的体积总比22.4 L大 | |
| D. | 1 mol H2和O2的混合气体,在标准状况下的体积大于22.4 L |
分析 A、根据m=nM来计算;
B、根据标况下气体体积V=nVm来计算;
C、气体体积和压强也有关;
D、依据气体摩尔体积概念分析,结合n=$\frac{V}{22.4}$计算判断.
解答 解:A、1 mol H2的质量=1mol×2g/mol=2 g,和温度压强无关,故A错误;
B、标况下气体体积V=nVm,标准状况下,某气体的体积是22.4 L,则可认为该气体的物质的量约是1 mol,故B正确;
C、压强不知,在20℃时,1 mol的任何气体的体积不一定比22.4 L大,故C错误;
D、1 mol H2和O2的混合气体,在标准状况下的体积一定约为22.4L,故D错误;
故选B.
点评 本题考查了气体摩尔体积的概念分析判断,注意概念的理解应用,掌握基础是关键.


科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入硝酸银溶液,白色沉淀生成,证明原溶液是盐酸 | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 向某溶液中加少量氯化钡溶液,若出现白色沉淀,说明原溶液中含有SO42- | |
| D. | 向某溶液中加入少量稀盐酸,产生的气体能使澄清石灰水变浑浊,则原溶液一定含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的蓝色石蕊试纸检验氨气 | |
| B. | 当浓氨水与浓硫酸反应会产生白烟 | |
| C. | 只用BaCl2溶液就可以鉴别SO42-和CO32- | |
| D. | 在化学实验中,点燃可燃性气体均需要验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
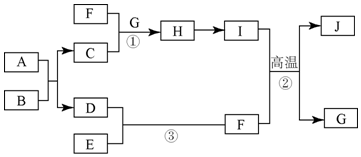
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2水置于棕色试剂瓶避光保存 | |
| B. | 盛NaOH溶液的试剂瓶用磨口玻璃塞 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氢化物沸点比M氢化物的沸点低 | |
| B. | X2Y2是离子化合物,MY2是共价化合物 | |
| C. | ZX可做还原剂,与水反应后溶液会显碱性 | |
| D. | 四种元素形成的化合物为强电解质,其水溶液会呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

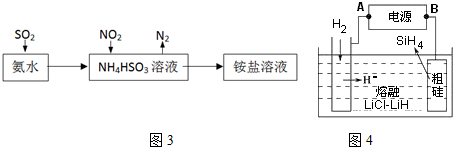
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com